L’implantologia è attualmente una delle terapie riabilitative di scelta per pazienti con edentulia parziale o totale.
Permette di riportare sia la funzionalità che l’estetica ad alti livelli con una prevedibilità di successo tra il 90 e il 95% (1).
L’infezione batterica può colpire solo la mucosa perimplantare (mucosite) (2) o coinvolgere anche l’osso di sostegno (perimplantite) (3).
Una corretta diagnosi di malattia perimplantare è essenziale per affrontare correttamente la malattia infiammatoria.
La terapia parodontale di supporto è un punto chiave per il mantenimento della salute orale del paziente impiantato.
Una delle domande che l’operatore deve porre è:
“Quali criteri dovrebbero essere considerati per progettare un programma di supporto che abbia un adeguato intervallo di richiamo per prevenire possibili complicanze infiammatorie dei tessuti perimplantari?”
Escludendo come fattori di rischio le complicanze postoperatorie e la perdita precoce dell’impianto, cercheremo di focalizzare i parametri diagnostici rilevanti nelle malattie perimplantari, con l’obiettivo di fornire linee guida che possono essere utili all’igienista dentale nella pratica clinica.
I criteri per il successo dell’impianto sono stati ampiamente descritti da Albrektsson durante il primo workshop europeo di parodontologia a Ittingen, Svizzera, nel 1993 (4) e sono in breve i seguenti.
- Assenza di mobilità.
- Assenza di disturbi soggettivi persistenti (dolore, sensazione di corpo estraneo, disestesia).
- Assenza di radiotrasparenza intorno all’impianto.
- Nessuna profondità della tasca > 5 mm.
- Nessun sanguinamento al sondaggio.
- Dopo il primo anno di carico, perdita ossea verticale non superiore a 0,2 mm (nel nostro protocollo miriamo più che altro nel mantenere stabili i parametri ottenuti a inizio terapia).Vediamo ora quali sono i potenziali fattori di rischio associati alle malattie perimplantari.
Suppurazione
La presenza di pus è il risultato di un’infezione e di una lesione infiammatoria; in uno studio condotto su 218 pazienti esaminati per complicanze biologiche su impianti osteointegrati da 9 a 14 anni, la presenza di pus è stata identificata come indice predittivo per l’evoluzione della perimplantite, con conseguente perdita di livello osseo (5).
Indice di sanguinamento
La presenza di sanguinamento a un leggero sondaggio (0.25N), è un parametro utile per la diagnosi di infiammazione della mucosa perimplantare. Lang et al. (6) in uno studio sperimentale hanno dimostrato che i siti perimplantari sani non avevano BOP, mentre il BOP aumenta nel 91% dei siti con perimplantite.
Il valore prognostico del BOP è stato studiato in un trial clinico prospettico che ha valutato la perdita progressiva di attacco in pazienti con perimplantite (7).
È stato poi confermato in un altro studio prospettico (8), in cui i siti con sanguinamento durante il richiamo, eseguito per un follow-up di 2 anni, hanno mostrato una malattia in corso. Pertanto, il BOP è considerata un parametro affidabile per la diagnosi di malattie perimplantari.
PPD e variazioni del livello di attacco clinico
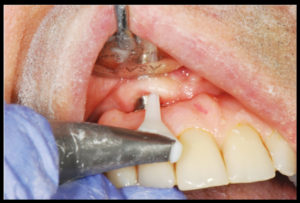
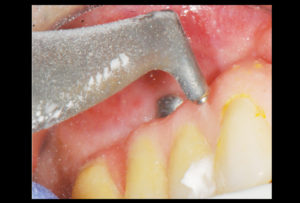
Il sondaggio parodontale è uno strumento essenziale per la diagnosi della malattia perimplantare. Studi sperimentali hanno dimostrato che un aumento della profondità di sondaggio nel tempo è associato alla perdita di attacco osseo (9).
Forza di sondaggio: in uno studio di tessuti perimplantari sani, la valutazione della resistenza dei tessuti al sondaggio perimplantare a diversi livelli di forza ha dimostrato che i tessuti perimplantari sono sensibili alle variazioni di forza.
In passato è stato suggerito che l’indagine intorno agli impianti poteva potenzialmente causare danni alla mucosa perimplantare, e quindi non è stata normalmente utilizzata.
Tuttavia, Etter et al. in uno studio sperimentale ha valutato un sondaggio con una forza di 0.25 N e ha osservato la completa riformazione della mucosa dopo 5 giorni, quindi l’indagine con una sonda parodontale effettuata con una leggera pressione di 0.25 N non causa danni ai tessuti perimplantaried è raccomandata per la valutazione degli stessi (10).
Analisi della saliva e del fluido crevicolare
La correlazione tra i marcatori biochimici dell’infiammazione e i parametri clinici di tessuti perimplantari sani e tessuti malati è stata al centro di recenti ricerche.
Il livello di mediatori biochimici secreti nel PICF (peri-implant crevicular fluid) è stato studiato con l’intenzione di identificare un marcatore diagnostico per monitorare la salute perimplantare.
Sono stati studiati marcatori PICF, inclusi citochine, enzimi e proteasi.
Più recentemente sono stati valutati campioni di saliva, che hanno il vantaggio di essere non invasivi e più facili da prelevare rispetto al PCIF.
Mentre questi test indicano un potenziale per i test diagnostici, per la perimplantite c’è la necessità di studi longitudinali prospettici per correlare la progressione della malattia con marcatori biochimici.
Gli studi stanno continuando nella ricerca di un test diagnostico sensibile per rilevare cambiamenti reversibili prima dei cambiamenti clinici perimplantari, a oggi, però, non è disponibile alcun test diagnostico biochimico per la progressione della parodontite.
Test microbiologico diagnostico
Luterbacher et al. hanno valutato un test microbiologico in combinazione con il BOP per monitorare lo stato del tessuto intorno all’impianto durante un periodo di richiamo di 2 anni.
A ogni visita di richiamo è stato prelevato un campione microbiologico a livello di impianto e sito dentale per identificare la presenza di specifici batteri (Aggregatibacter actinomicetemcomitans, Prevotella intermedia, Porphiromonas gingivalis e Treponema denticola) ed è stata registrata anche la presenza o assenza di BOP (8).
Durante il periodo di follow-up è stata calcolata la percentuale di visite di richiamo con test batteriologici positivi e positività della BOP.
La profondità di sondaggio perimplantare è stata monitorata per identificare la progressione della malattia perimplantare.
L’aggiunta dei risultati dei test microbiologici è stata riportata per aumentare l’importanza prognostica della sola BOP nell’identificazione della progressione della malattia a livello dell’impianto.
Valutazione radiografica
Le tecniche radiografiche, compresa l’ortopantomografia e la radiografia intraorale con la tecnica del fascio parallelo, sono state ampiamente utilizzate per monitorare i livelli di osso marginale sugli impianti e diagnosticare la perdita ossea interprossimale.
La distanza da un punto di riferimento fisso al livello dell’osso interprossimale viene registrata e monitorata longitudinalmente.
Mentre l’ortopantomografia fornisce una visione d’insieme degli impianti, ci sono limitazioni che includono la risoluzione e la distorsione dell’immagine stessa.
Altri limiti della radiografia convenzionale includono l’incapacità di monitorare i livelli dell’osso vestibolare e linguale/palatale, la bassa sensibilità alla diagnosi precoce dei cambiamenti ossei e la sottovalutazione dell’entità della perdita ossea.
L’uso dell’analisi delle immagini assistita da computer può migliorare l’accuratezza diagnostica dei raggi X, rilevando piccole variazioni nella densità ossea.
La tomografia è la tecnica più utilizzata per i casi di studio nella riabilitazione implantare, offrendo il vantaggio di rappresentare le strutture ossee nei 3 piani su scala reale e senza distorsioni.
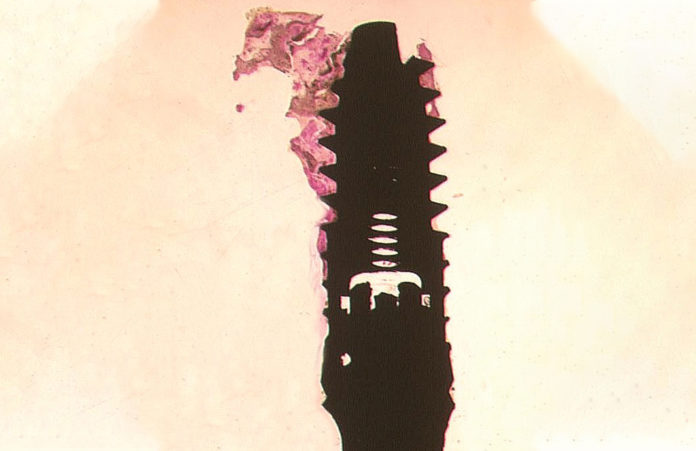
Mengel et al., in uno studio sperimentale sulle mandibole di maiale, hanno valutato l’accuratezza e la qualità della rappresentazione dei difetti perimplantari con radiografia intraorale, radiografia panoramica, TC e tecnica a fascio parallelo.
Sia la TC che la tecnica a raggi paralleli forniscono un’accurata rappresentazione tridimensionale dei difetti ossei perimplantari (11).
Diabete
Il diabete è una malattia sistemica che è il risultato di innumerevoli meccanismi che possono ritardare la guarigione della ferita, aumentando così la sensibilità del paziente alle infezioni o alla perdita dell’impianto (12).
Esiste un solo studio che descrive l’associazione tra diabete e perimplantite: nel 2006 Ferreira et al. in uno studio trasversale su 212 soggetti non fumatori ha dimostrato che uno scarso controllo metabolico nei soggetti con diabete è associato a malattia perimplantare.
Genetica
L’interleuchina1α, IL1β e i loro specifici inibitori dell’infiammazione IL-1ra svolgono un ruolo chiave nella regolazione della risposta infiammatoria.
L’identificazione del polimorfismo genico nell’infezione perimplantare è stata studiata in diversi studi clinici con risultati contrastanti.
Una recente revisione ha cercato di chiarire se esiste un’associazione tra interleuchina 1 positiva e aumento della perdita ossea perimplantare. Dall’analisi di 44 pubblicazioni scientificamente rilevanti, solo 2 studi sono stati significativi, dimostrando che ci sono prove che possono supportare l’associazione tra lo stato del fumo IL- 1+ e lo sviluppo della perimplantite.
Inoltre, una maggiore incidenza di malattia perimplantare è stata dimostrata in pazienti che fumano con IL-1+ (13).
Fumo
L’effetto del fumo di sigaretta sui tessuti perimplantari è stato documentato in numerosi studi.
Strietzel et al. hanno pubblicato una meta-analisi per studiare se il fumo ha interferito con la prognosi dell’impianto. Poiché la definizione di fumatore variava negli studi (per quanto riguarda il numero di sigarette fumate al giorno), in questa revisione ogni paziente che fumava era considerato un fumatore.
Questa revisione indica in modo significativo i rischi di complicanze biologiche nei fumatori rispetto ai non fumatori.
Alcuni studi inclusi in questa revisione hanno riportato la frequenza della malattia perimplantare, aumento dell’infiammazione, suppurazione, formazione di fistole, perimplantite, perdita ossea, alto tasso di sanguinamento, infiammazione della mucosa perimplantare.
Questa revisione include anche studi sull’influenza del fumo sulle alterazioni ossee marginali perimplantari che hanno mostrato un significativo aumento della perdita ossea marginale nei fumatori rispetto ai non fumatori (13).
Ulteriori studi hanno dimostrato che la perdita ossea perimplantare era associata al consumo abituale di sigarette.
TPS nel paziente con impianto durante il follow-up a medio e lungo termine
Come detto in precedenza, i fattori di rischio possono contribuire da soli o in associazione con lo sviluppo di patologie perimplantari, da qui la necessità di controllo e monitoraggio delle stesse.
L’evidenza clinica ci ha portato a considerare anche il tipo di protesi realizzata durante la riabilitazione.
La scelta di includere nel protocollo il “tipo di protesi” nei fattori di rischio è motivata dalla constatazione che, nella pratica clinica, i diversi tipi di protesi possono influenzare la corretta igiene orale domiciliare dell’impianto da parte del paziente.
Infatti, il paziente può avere oggettive difficoltà nel rimuovere i depositi molli dalle strutture protesiche.
La struttura e talvolta la complessità del progetto protesico può rappresentare una reale difficoltà di gestione per il paziente, impedendogli di raggiungere un livello ottimale di igiene orale a casa.
La presenza di placca “difficile da rimuovere” può quindi contribuire, oltre ai fattori di rischio sopra citati, a indurre patologie ai tessuti perimplantari.
Il protocollo
Presso il Centro Universitario di Igiene Orale e Prevenzione del cavo orale dell’Ospedale San Raffaele di Milano, è stato elaborato un protocollo che valuta i fattori di rischio che possono concorrere all’eziopatogenesi della malattia perimplantare, quali:
- tipologia di protesi realizzata,
- fumo;
- igiene orale domiciliare,
- parodontopatia pregressa;
- diabete.
Nel protocollo è stata inserita la variabile tipologia di protesi realizzata nella terapia implantoprotesica tra i fattori di rischio in quanto, nella pratica clinica, le diverse tipologie di protesi possono influire nel controllo di una corretta igiene orale domiciliare del paziente implantosupportato.
Il paziente può incontrare delle difficoltà oggettive nella rimozione dei depositi molli dalle strutture protesiche.
L’architettura e a volte la complessità del progetto protesico possono rappresentare per il paziente una reale difficoltà di gestione, impedendogli di raggiungere un livello di igiene orale domiciliare ottimale.
La presenza di placca “difficile da rimuovere” può contribuire dunque, così come i fattori di rischio precedentemente citati, a indurre patologie a carico dei tessuti perimplantari.
Dopo aver constatato la salute dei tessuti perimplantari, il paziente viene inserito nel protocollo calcolandone il profilo di rischio.
Metodo di calcolo del rischio
Il presente metodo di determinazione del rischio è basato sulla valutazione dei 5 fattori/indicatori di rischio descritti precedentemente, correlati con l’insorgenza delle patologie perimplantari. A ciascun fattore/indicatore viene assegnato un punteggio indicativo dell’importanza che il singolo fattore/indicatore ha sul livello di rischio all’insorgenza di patologie perimplantari (Tab. 1, 2, 3, 4 e 5).
1a. Tipologia di protesi fissa realizzata nella terapia implantoprotesica
| Corona singola | Ponte | Circolare | Circolare con gengiva finta | Protesi Toronto |
|---|---|---|---|---|
| Rischio | Rischio | Rischio | Rischio | Rischio |
| Punto 0 | Punto 1 | Punti 2 | Punti 3 | Punti 4 |
1b. Tipologia di protesi mobile realizzata nella terapia implantoprotesica
| Overdentures |
|---|
| su sfere Ovendentures |
| su barra Telescopica/ |
| Doppia struttura |
| Rischio Rischio Rischio |
| Punti 4 Punti 5 Punti 6 |
2. Fumo
| Overdentures su sfere | Ovendentures su barra | Telescopica/Doppia struttura |
|---|---|---|
| Rischio | Rischio | Rischio |
| Punti 4 | Punti 5 | Punti 6 |
3. Igiene orale domiciliare
| Non fumatore | 1/9 sigarette al giorno | 10/19 sigarette al giorno | 20 o più sigarette al giorno |
|---|---|---|---|
| Rischio | Rischio | Rischio | Rischio |
| Punti 0 | Punti 1 | Punti 2 | Punti 3 |
4. Presenza di parodontopatia pregressa
| <=25% | Fino 50% | Da 50 a 75% | >=75% |
|---|---|---|---|
| Rischio | Rischio | Rischio | Rischio |
| Punti 0 | Punti 1 | Punti 2 | Punti 3 |
Per ottenere il valore totale attribuibile al livello di rischio individuale, i punteggi di ciascun fattore/indicatore di rischio devono essere successivamente sommati (Tab. 6).
5. Diabete
| Si | No |
|---|---|
| Rischio | Rischio |
| Punti 1 | Punti 0 |
Calcolo del livello di rischio individuale e intervallo di mantenimento
Una volta assegnati i punteggi relativi a ciascuno dei fattori/indicatori di rischio in esame, viene ricavata la somma algebrica dei singoli punteggi (Tab. 7), ottenendo un conteggio finale.
Conteggio totale: profilo di rischio
| Non diabetico | Diabetico con sufficiente compenso metabolico | Diabetico con insufficiente compenso metabolico |
|---|---|---|
| Rischio | Rischio | Rischio |
| Punti 0 | Punti 1 | Punti 2 |
Il punteggio finale ottenuto permette l’attribuzione del livello di rischio specifico del singolo paziente.
I livelli di rischio finale complessivo sono suddivisi attribuendo a ciascuna classe di rischio i seguenti valori:
BASSO: da 0 a 5 punti
MEDIO: da 6 a 10 punti
ALTO: da 11 a 15 punti
Al livello di rischio ottenuto viene associato un protocollo preventivo-terapeutico specifico che tenga in considerazione la determinante tempo (Tab. 8).
Al profilo di rischio assegnato vengono successivamente applicati i protocolli preventivo/terapeutici riportati negli schemi di seguito.
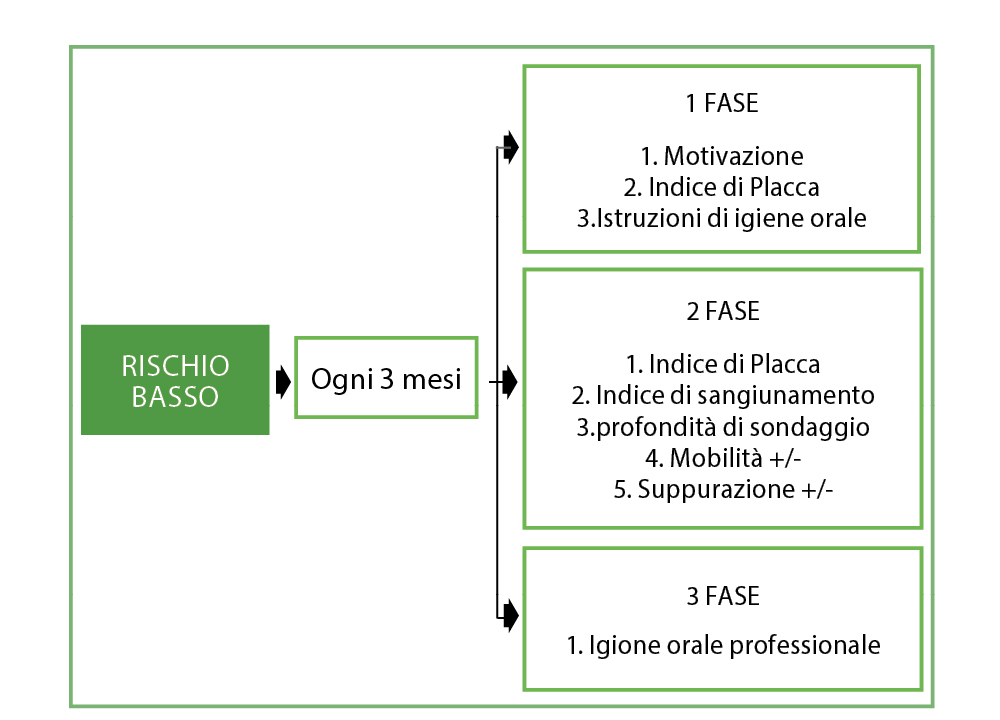
Rischio basso
(Tab. 9)
Rischio medio
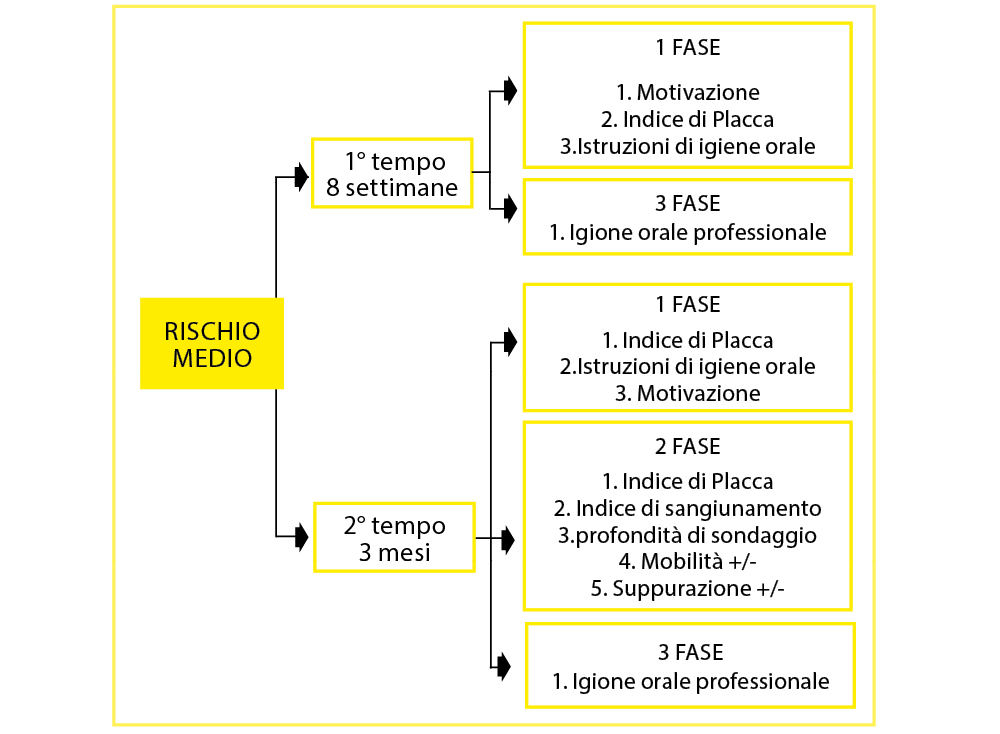
Il paziente con il profilo di rischio medio seguirà un intervallo di mantenimento suddiviso in 2 TEMPI (Tab. 10).
Rischio alto
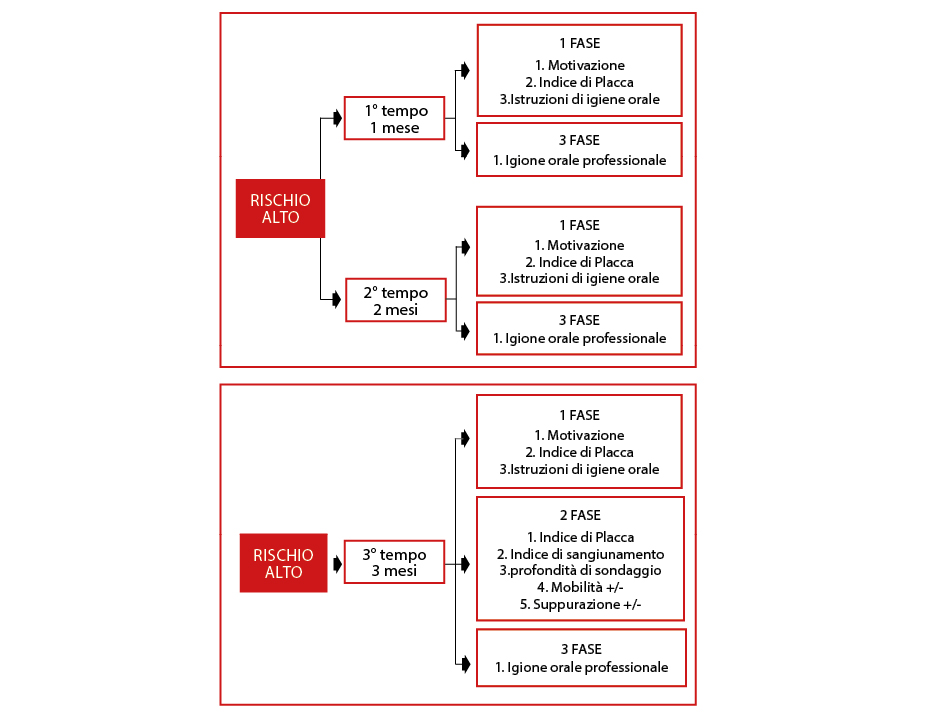
Il paziente con il profilo di rischio alto seguirà un intervallo di mantenimento suddiviso in 3 TEMPI (Tab. 11).
Bibliografia
- Roos-Jansaker AM, Lindahl C, Renvert H, Renvert S. Nine-to fourteen-year follow-up of implant treatment. Part I: implant loss and associations to various factors. J Clin Periodontol 2006; 33(4):289-9.
- Berglundh T, Lindhe J, Marinello C, Ericsson I, Lijenberg B. Soft tissue reaction to de novo plaque formation on implants and teeth. An experimental study in the dog. Clin Oral Implant Res 1992; 3(1):1-8.
- Albrektsson T, Canullo L, Cochran D, De Bruyn H. “Peri-Implantitis”: A Complication of a Foreign Body or a Man-Made “Disease”. Facts and Fiction. Clin Implant Dent Relat Res 2016; 18(4)840-9.
- Albrektsson T, Zarb GA. Current interpretations of the osseointegrated response: clinical significance. Int J Prosthodont 1993; 6(2):95-105.
- Roos-Janseker AM, Lindhal C, Renvert H, Renvert S. Nine- to fourteen-year follow-up of implant treatment. Part II: presence of peri-implant lesions. J Clin Periodontol 2006; 33(4):290-5.
- Buser D, Mericske-Stern R, Bernard JP, Behenke A, Behenke N, Hirt HP, Belser UC, Lang NP. Long-termevaluationofnon-submerged ITI implants. Part 1: 8-year life table analysis of a prospective multi-center study with 2359 implants. Clin Oral Implants Res 1997; 8(3):161-72.
- Jepsen K, Jepsen J, Laine ML, Anssari Moin D, Pilloni A, Zeza B, Sanz M, Ortiz-Vigon A, Roos-Jansaker AM, Renvert S. Reconstruction of Peri-implant Osseous Defects: A Multicenter Randomized Trial. J Dent Res 2016; 95(1)58-66.
- Luterbacher S, Mayfield L, Bragger U, Lang NP. Diagnostic characteristics of clinical and microbiological tests for monitoring periodontal and peri-implant mucosal tissue conditions during supportive periodontal therapy (SPT). Clin Oral Implants 2000; 11(6):521-9.
- Lang NP, Bragger U, Walther D, Beamer B, Kornman KS. Ligature-induced peri-implant infection in cynomolgus monkeys. I. Clinical and radiographic findings. Clin Oral Implants Res 1993; 4(1):2-11.
- Etter TH, Hakanson I, Lang NP, Trejo PM, Caffesse RG. Healing after standardized clinical probing of the perlimplant soft tissue seal: a histomorphometric study in dogs. Clin Oral Implants Res 2002; 13(6):571-80.
- Kehl M, Swierkot K, Mengel R. Three-dimensional measurement of bone loss at implants in patients with periodontal disease. J Periodontol 2011; 82(5):689-99.
- Fiorellini JP, Nevins MI. Dental implant considerations in the diabetic patient. Periodontol 2000; 23:73-7.
- Gruica B, Wang HY, Lang NP, Buser D. Impact of IL-1 genotype and smoking status on the prognosis of osseointegrated implants. Clin Oral Implants Res 2004; 15(4):393-400.