Fino a qualche decennio fa si pensava che i batteri esistessero e vivessero come cellule solitarie e, in quanto tali, non fossero in grado di eseguire complessi compiti come quelli ascrivibili agli organismi multicellulari. Di conseguenza, i batteri sono stati spesso studiati generalmente in sospensioni costituite da un mezzo liquido, rispecchiando così una prima loro modalità di comportamento, la cosiddetta modalità fluttuante, o planctonica, nella quale le cellule separate fluttuano o nuotano in maniera indipendente in un supporto liquido. Tuttavia, tale stile di vita non risulta essere quello preferito dai batteri in natura; infatti, ora è evidente che i batteri di solito crescono nei biofilm o micropellicole o microfouling, cioè aggregazioni complesse di microrganismi, responsabili, ad oggi, della stragrande maggioranza delle infezioni batteriche che colpiscono le persone.
In tale contesto è noto che vari simbionti microbici e i loro genomi sono in stretta associazione con il biologico funzionamento del corpo umano. Infatti, la popolazione microbica forma estese colonie a ridosso delle superfici interne come di quelle esterne dei nostri corpi, sviluppando un sistema operativo che è di fondamentale importanza per la nostra salute. Tali popolazioni batteriche sono estremamente complesse, ad esempio quelle che colonizzano la bocca sono costituite da circa 750 specie, e milioni di cellule/mg (1, 2), una stima numerica seconda solo alle specie batteriche presenti nel colon (3).
Sebbene i biofilm possano formarsi su quasi tutti i tipi di superfici degli esseri viventi e non viventi, e sono fenomeni universali all’interno di ecosistemi naturali, industriali e medici, il biofilm che costituisce gran parte della placca dentale, sicuramente è uno tra i più studiati. Tale interesse risiede nel fatto che i biofilm dentali rappresentano importanti fattori eziologici che intervengono nelle malattie orali ponendo problemi di salute pubblica a livello globale (4).
Così, tra i dentisti, e non a caso, la placca dentale era di interesse centrale molto prima che il termine “biofilm” diventasse un concetto comune; in pratica, i dentisti trascorrono una buona parte del loro tempo a riparare e a prevenire le conseguenze legate ai biofilm.
COMPOSIZIONE DEL BIOFILM DENTALE
Seconda una definizione un po’ più formale, i biofilm sono comunità strutturate di microrganismi attaccati a una superficie e avviluppati in una matrice polimerica extracellulare (5, 6). Di certo, i progressi nelle tecnologie di sequenziamento del DNA e dell’RNA stanno rivelando informazioni importanti sulla diversità di composizione, contenuto del genoma e comportamenti del microbiota del biofilm in diversi siti orali. Parallelamente, la conoscenza degli impatti biologici della matrice extracellulare nel governare le interazioni cellula-cellula, creare microambienti e modificare la virulenza dei biofilm, continua ad aumentare la nostra comprensione della patogenesi delle malattie infettive (5, 7).
Ci sono molti fattori che influenzano la composizione del microbiota che si trova su varie superfici della bocca, specialmente quando i denti iniziano a emergere, fornendo così nuove superfici idonee per la colonizzazione da parte sia di commensali sia di patogeni opportunisti. Questi includono, ma non sono limitati a, età, dieta, igiene orale, condizioni sistemiche e immunitarie e l’uso di alcuni farmaci che inducono ad esempio l’iposalivazione. Il ruolo critico che la dieta svolge nella colonizzazione microbica è ben illustrato nei pazienti o negli animali da esperimento (8, 9). Quando gli ospiti sono sovraesposti agli zuccheri alimentari, la struttura e la composizione dei biofilm che si sono formati sui denti cambia in modo significativo e le comunità microbiche residenti diventano altamente adatte a metabolizzare i carboidrati, producendo, tra l’altro, acidi che contribuiscono alla formazione della carie dentale (10, 11). È interessante porre in evidenza che il sequenziamento effettuato su placche dentali di organismi fossili, ha fornito ulteriori prove che confermano come i cambiamenti nel microbiota orale siano associati a cambiamenti nella dieta (12). Ad esempio, lo Streptococcus mutans (un batterio cariogeno) non è stato rilevato nei campioni di placche di fossili neolitici o mesolitici (12). Tuttavia, solo quando gli esseri umani hanno cominciato a sviluppare e adottare un’agricoltura con una dieta ricca di zuccheri, Streptococcus mutans ha iniziato a comparire nella documentazione sui fossili ed è diventato sempre più diffuso a mano a mano che nella dieta gli zuccheri raffinati aumentavano continuamente, così come l’incidenza della carie dentale (12).
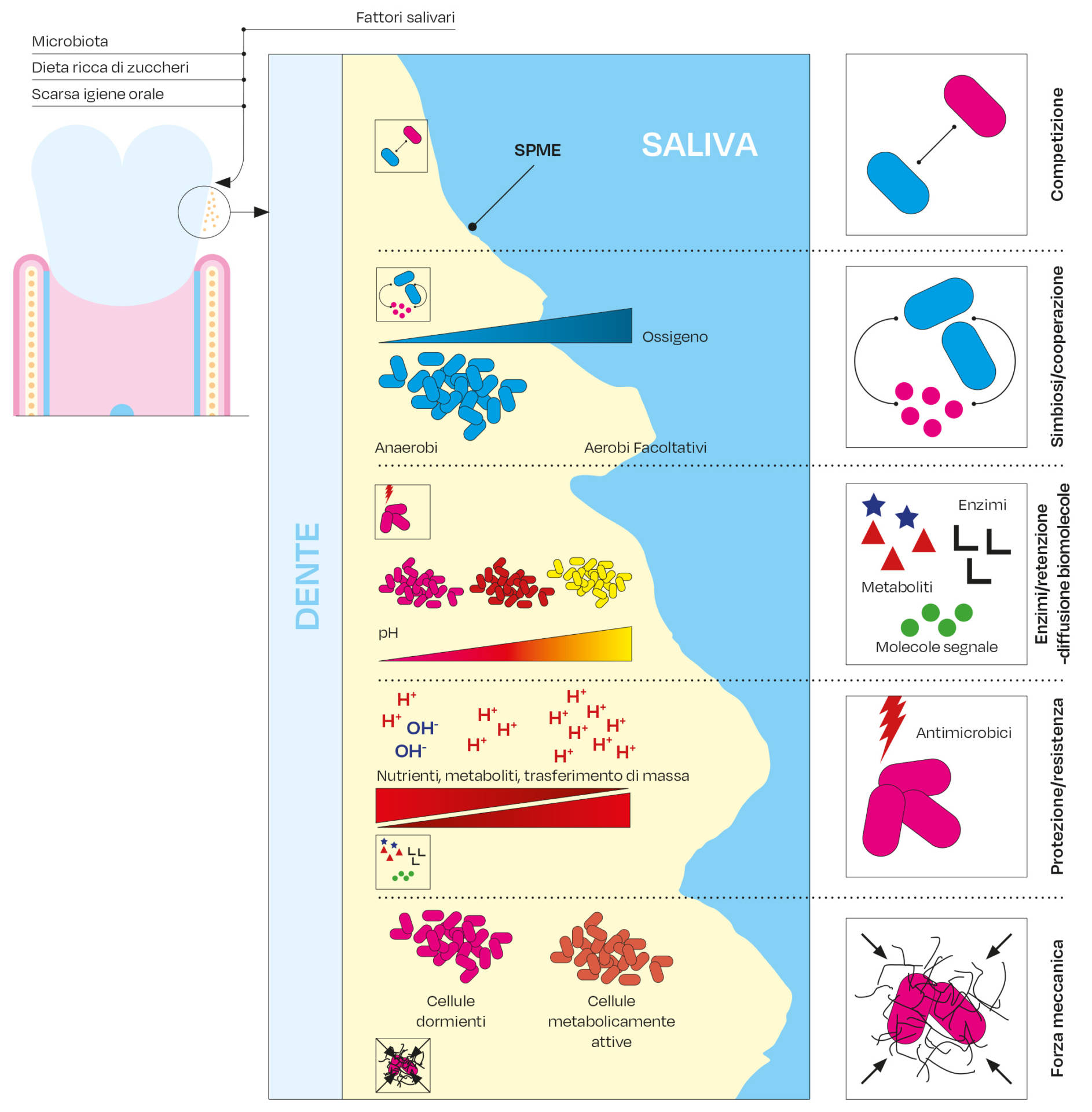
Sebbene i primi studi si concentrassero sulla composizione microbica dei biofilm, ora è chiaro che i microrganismi che risiedono all’interno dei biofilm sono incorporati in una matrice extracellulare contenente sostanze polimeriche (SPME: sostanze polimeriche della matrice extracellulare). L’importanza della matrice nel comportamento microbico collettivo e nella virulenza, nonché nella tolleranza degli antimicrobici, viene sempre più riconosciuta e considerata parte integrante dello stile di vita del biofilm (5,6, 13). La produzione di SPME contribuisce direttamente sia all’adesione microbica su una superficie sia all’adesione cellula-cellula, mentre contribuisce a formare una matrice polimerica che migliora la stabilità meccanica del biofilm. Inoltre, le proprietà delle SPME, modificando la costituzione della matrice, portano alla formazione di gradienti chimici e nutrizionali, creando così, all’interno dei biofilm, microambienti che possono variare ampiamente tanto da influenzare i comportamenti microbici, come pure i valori di pH, lo stato redox e la disponibilità dei nutrienti. Pertanto, la matrice consente alle cellule di organizzarsi in ecosistemi multicellulari coesi in cui si verificano interazioni cooperative e antagoniste all’interno di un ambiente chimico e fisico eterogeneo (5), contribuendo a creare nicchie localizzate con diversi potenziali batteri patogeni.
Con l’evolversi sia della microbiomica la scienza che studia il microbioma, cioè l’insieme del patrimonio genetico e delle interazioni ambientali della totalità dei microrganismi di un ambiente definito come potrebbe essere lo stesso corpo umano o parti di esso, come ad esempio, l’intestino, la cute, la bocca sia della biologia della matrice extracellulare, è diventato chiaro che le interazioni polimicrobiche e il microambiente del biofilm locale svolgono un ruolo fondamentale nella modulazione delle condizioni di salute e della malattia (14-16). Al contrario, decenni di ricerca hanno chiaramente dimostrato che i patogeni hanno sviluppato un arsenale di meccanismi per aumentare il potenziale di virulenza dello stesso biofilm (17-19). I cambiamenti sperimentati dall’ospite (ad esempio un aumento del consumo di zuccheri o alterazioni delle risposte immunitarie) possono innescare agenti patogeni capaci di rimodellare il microambiente locale nonché la comunità microbica. Tuttavia, si sa poco su come i patogeni modifichino l’organizzazione spazio-temporale e il loro comportamento comunitario, al fine di creare nicchie patologiche localizzate. Inoltre, il modo in cui commensali e agenti patogeni coesistono e combattono tra loro all’interno di una matrice di biofilm per mediare il processo patologico rimane tuttora scarsamente definito.
La componente molecolare: le sostanze polimeriche della matrice extracellulare (SPME)
I recenti progressi nella comprensione della biologia della matrice extracellulare hanno rivelato una “impalcatura multifunzionale” essenziale per lo stile di vita del biofilm (1, 13). Le caratteristiche strutturali e biochimiche della matrice forniscono le particolarità emergenti dei biofilm, tra cui l’adesione superficiale, le eterogeneità spaziali e chimiche, le interazioni sinergiche/competitive nonché la maggiore tolleranza agli antimicrobici (5). La formazione delle SPME dipende dalla disponibilità del substrato, dalla sintesi e dalla secrezione di materiali extracellulari, come pure dal proprio rimodellamento e da altre condizioni di stress. In ogni modo, i principali componenti della matrice nei biofilm orali associati alla carie dentale sono gli esopolisaccaridi, in particolare i glucani derivati da Streptococcus mutans (20). Sono inoltre presenti glucani e fruttani solubili prodotti da altre specie (per es. Actinomyces, Streptococcus salivarius e Streptococcus gordonii) e ibridi amido-glucani. Come altre matrici, anche i biofilm cariogeni sembrano contenere DNA extracellulare (eDNA) (21), proteine di derivazione batterica che possiedono proprietà simili all’amiloide (22), nonché proteine ospiti e glicoproteine, che possono contribuire all’impalcatura della matrice spesso in associazione con i glucani (ad esempio complessi eDNA-glucano) (23). Tuttavia, la funzione e l’organizzazione strutturale di questi altri esopolimeri nella matrice rimangono poco conosciute e sono necessari ulteriori studi per chiarire il loro ruolo sulla composizione microbica e sul potenziale cariogenico del biofilm.
Nello specifico, molti tipi di SPME sono polianionici a causa della presenza di acidi uronici (acidi D-glucuronico, D-galatturonico o D-mannuronico) oppure di un residuo di piruvato legato attraverso la formazione di un chetale. Anche alcuni residui di natura inorganica, come il fosfato o il solfato, contribuiscono alla carica negativa e a modifiche come l’O-acetilazione, ma anche l’epimerizzazione del residuo zuccherino contribuiscono ulteriormente alla complessità delle SPME.
In molti casi, le SPME sono rappresentate da un omoglicano composto da residui di N-acetilglucosamina con legame β-1,6 noto come poli-N-acetilglucosamina (o PNAG), come esemplificato dal polimero adesivo ottenuto dai ceppi di Staphylococcus epidermidis che producono biofilm sui cateteri. La formazione di PNAG è molto comune tra i vari agenti patogeni orali e batteri multiresistenti, con conseguenti sforzi concertati di ricerca e approcci terapeutici che mirano a questo polimero, soprattutto perché è stato osservato che gli anticorpi prodotti contro la forma deacetilata della PNAG mediano l’uccisione dei batteri per via opsonica. È interessante notare che l’agente patogeno parodontale Aggregatibacter actinomycetemcomitans, noto in precedenza come Actinobacillus actinomycetemcomitans, secerne un enzima in grado di idrolizzare la PNAG, noto come dispersina B (DspB) che ha dimostrato disperdere efficacemente i biofilm formati dai batteri produttori di PNAG ed è quindi in fase di sviluppo anche come coadiuvante della terapia antibiotica.
Tuttavia, in generale, i glucani sono costituiti da frazioni di glucosio collegate principalmente da legami glicosidici α-1,3 e α-1,6 prodotti da un’azione concertata di esoenzimi streptococcici chiamati glucosiltransferasi (GT) (20, 24).
Curiosamente, detti enzimi GT rilasciati a livello extracellulare possono legarsi alla superficie del dente in forma attiva producendo glucani in situ che forniscono nuovi siti di legame per i batteri. Inoltre, gli enzimi GT secreti si legano anche ad altri microbi orali (streptococchi commensali, actinomyces, lattobacilli e persino Candida albicans), convertendoli così in produttori di glucano. I glucani delle SPME che si formano sulle superfici, di norma inducono un accumulo di microbi sui denti, dando luogo a nuove interazioni interspecie e aumentando la coesione cellula-cellula. Utilizzando l’incorporazione diretta di sonde fluorescenti durante la sintesi di glucani da parte delle glucosiltransferasi, è emerso un quadro dettagliato dell’ordine spazio-temporale dell’assemblaggio delle SPME e della sua disposizione spaziale rispetto alle cellule batteriche in biofilm costituiti da specie miste (25). Questi polimeri extracellulari si accumulano in diverse posizioni sulla superficie di apatiti, cioè minerali con formula generica Ca5(PO4)3[F, OH, Cl], e sulla membrana cellulare, ciascuno con ruoli complementari per formare una matrice di SPME nascente e coordinare lo sviluppo del biofilm, tra cui: aderenza superficiale, adesione cellula-cellula e formazione di ammassi cellulari simili alle microcolonie trovate in altri sistemi di biofilm (6).
A mano a mano che il biofilm matura, la continua produzione in situ di SPME espande la matrice tridimensionalmente, racchiudendo le cellule in cluster o agglomerati e, nello stesso tempo, creando un ponte da un versante all’altro, si forma così una struttura altamente compartimentata, ma coesiva all’interno di un’impalcatura a matrice tridimensionale. Tale organizzazione spaziale ed eterogeneità, modellate dalla sintesi delle SPME, potrebbero spiegare il rilevamento di diversi cluster microbici di dimensioni e composizione diverse trovati nei biofilm orali umani (26, 27). In tale contesto, la Figura 1 mostra il complesso microambiente presente nel biofilm dentale.
Come è stato osservato, la deposizione di SPME sulle superfici e lo sviluppo nella stessa matrice polimerica influenzano anche le proprietà meccaniche dei biofilm, come l’aumento della forza adesiva alle superfici e la coesione (28). I biofilm ben consolidati sono meccanicamente difficili da rimuovere dalle superfici dei denti e spesso mostrano una maggiore viscoelasticità, che può aiutarli a persistere cedendo solo parzialmente piuttosto che staccarsi quando sottoposti a sollecitazioni indotte con un semplice taglio. Ad ogni modo, tutta la matrice extracellulare, con le annesse sostanze polimeriche, può essere costantemente rimodellata localmente attraverso le azioni di destrinasi, DNAsi ed enzimi proteolitici che alterano dinamicamente le proprietà meccaniche e/o espongono nuovi siti di legame a microrganismi aggiuntivi che non erano disponibili durante l’inizio del biofilm (20). In effetti, la rigidità della matrice sembra aumentare con la maturazione del biofilm.
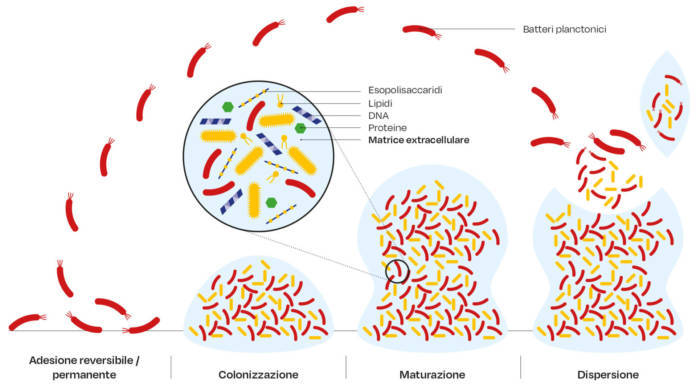
Nelle fasi successive, i biofilm maturi possono rilasciare piccoli aggregati o anche singole cellule (un processo chiamato dispersione), spesso attraverso la degradazione della matrice, per occupare, utilizzare siti non colonizzati e ricominciare il ciclo di vita del biofilm (29). Le proprietà fisico-chimiche della matrice del biofilm possono anche fornire protezione ai batteri incorporati riducendo l’accesso ai farmaci e innescando la tolleranza antimicrobica. Ad esempio, molte SPME possono legare antimicrobici cationici come la clorexidina e altri peptidi antimicrobici impedendo la penetrazione negli strati più profondi del biofilm, riducendo così l’efficacia dell’antimicrobico (25, 30).
La componente microbica: il microbiota
Il microbiota orale è un complicato ambiente ecologico con circa 750 tipi di microrganismi riconosciuti (1) e per tale motivo la popolazione microbica orale è una delle flore batteriche più complesse presenti nel corpo umano (31). Ad ogni modo, nonostante la ricerca sulla placca dentale vada avanti da oltre un secolo, considerare la placca dentale come un biofilm e un ecosistema microbiologico è un concetto abbastanza recente. Di conseguenza, la placca dentale, considerata come un tipico biofilm orale, è essa stessa un ecosistema estremamente attivo e complicato (32) e non a caso una serie di evidenze sperimentali indicano che in diverse condizioni i batteri presenti nel biofilm risultano essere i principali responsabili di problemi a carico dei denti (33).
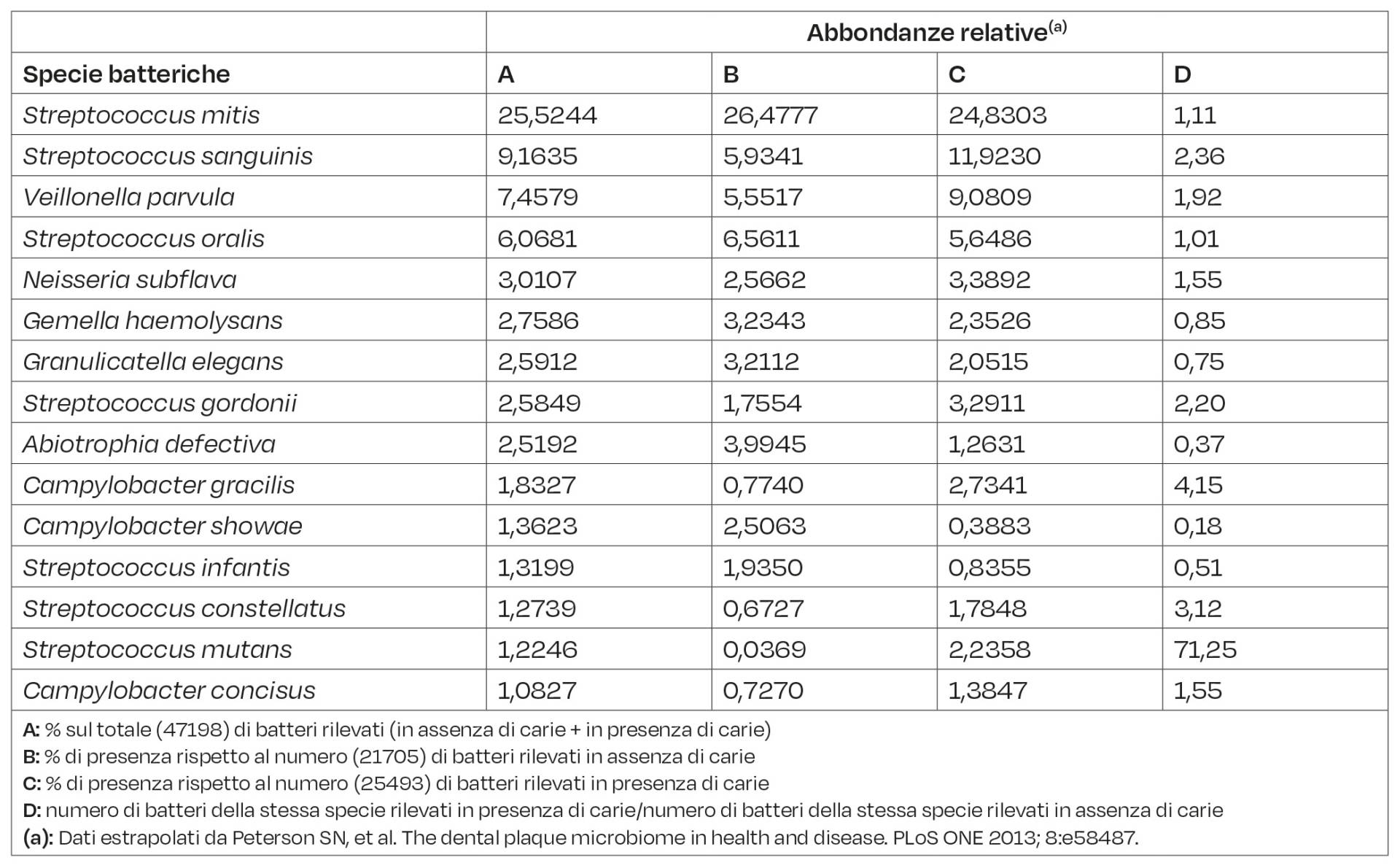
Da evidenziare che relativamente al biofilm della placca dentale, oltre alle tipologie di famiglie (phyla) di batteri in esso presenti, di volta in volta, se e quando necessario, sarebbe opportuno fare una distinzione, in particolare se si è in presenza di carie o in assenza di carie, distinzione che nel presente questo studio viene presa in considerazione per le 15 specie maggiormente presenti nella placca dentale (TAB. 1). Dalla stessa tabella si evince che, rispetto alle restanti tipologie di specie batteriche, lo Streptococcus mutans pur essendo presente in bassissima percentuale (1,2246; Colonna A) è la specie che in presenza di carie mostra in assoluto il maggiore aumento (71,25; Colonna D) quando confrontata in assenza di carie. Inoltre, anche per altre specie batteriche si riscontra un aumento quando isolate in presenza di carie, ma tali aumenti sono molto più contenuti (per es. Campylobacter gracilis = 4,15; Streptococcus constellatus = 3,12; Streptococcus sanguinis = 2,36; Colonna D). Dall’altra parte, per alcune specie si nota un’inversione, cioè sono maggiormente presenti in assenza di carie che non in presenza di carie (per es. Campylobacter showae = 0,18; Abiotrophia defectiva = 0,37; Streptococcus infantis = 0,51; Colonna D). Per la maggior parte delle restanti specie non si riscontra una evidente differenza se isolate in presenza o in assenza di carie, essendo il rapporto intorno a 1 (Tab. 1; Colonna D). Ad ogni modo, tra i phyla di batteri più rappresentativi nella placca dentale troviamo:
- Actinobacteria: batteri Gram-positivi, aerobici, ma con qualche eccezione; morfologia filamentosa; con un alto contenuto di citosine e guanine nel proprio DNA; uno dei phyla batterici maggiormente rappresentati in natura;
- Bacteroidetes: batteri Gram-negativi, anaerobi che colonizzano, oltre alla cavità orale, l’intero tratto gastrointestinale compreso lo stomaco, nonostante in quest’ultimo organo, la presenza di enzimi e succhi gastrici molto acidi;
- Firmicutes: batteri Gram-positivi, con un basso contenuto di citosine e guanine nel proprio DNA; morfologia a forma di bastoncino; possono essere aerobi obbligati o anaerobi facoltativi. Generi presenti nel biofilm dentale: Gemella, Abiotrophia, Granulicatella; Veillonella, Eubacterium, Parvimonas, Mogibacterium, Catonella, Peptostreptococcus, Centipeda, Dialister, Megasphaeara, Mitsuokella, Selenomonas, Solobacterium; Streptococcus;
- Fusobacteria: batteri Gram-negativi, anaerobi obbligati a forma di bastoncino. Generi presenti nel biofilm dentale: Fusobacterium, Leptotrichia;
- Proteobacteria: batteri Gram-negativi, comprendono specie strettamente aerobiche e anaerobiche, aerobi facoltativi e microaerofili. Generi presenti nel biofilm dentale: Kingella, Neisseria Simonsiella, Campylobacter, Cardiobacter, Haemophilus, Lautropia.
Comunque, nel loro insieme i vari biofilm della placca dentale, esaminati in assenza o in presenza di carie supportano l’opinione che essi rappresentino una nicchia ecologica e un ambiente altamente selettivo visto che solo per alcuni phyla è stata osservata un’abbondanza apprezzabile e tra questi i Firmicutes sono i phyla dominanti. La presenza di un relativamente scarso numero di generi, che rappresenta invece un numero molto più grande di specie, si ipotizza possa migliorare il repertorio biochimico e la complementarità delle funzioni codificate all’interno della comunità della placca dentale. Di certo, la condivisione del “carico biochimico” tra i membri della comunità crea reti di relazioni mutualistiche. La ridondanza funzionale inerente alle relative specie potrebbe essere, in un certo qual senso, qualcosa di inusuale e insolito per una determinata specie, ma invece essere “essenziale” per la comunità microbica.
Questa caratteristica del microbiota potrebbe spiegare la variabilità osservata tra un soggetto e all’altro, come riscontrato nei microbiomi umani. Anche se l’estensione della variabilità interpersonale nella composizione microbica della placca dentale, all’interno e in un territorio più vasto e vario, in gran parte, non è stata ancora ben caratterizzata, è molto probabile che quanto prima si possa giungere a una maggiore comprensione dei risultati che si ottengono in tutti quegli studi dove viene esaminata la carie dentale. Tuttavia, è ipotizzabile pensare che una tale variabilità interpersonale delle comunità microbiche contribuisca a una evoluzione più favorevole.
Certamente, nel loro insieme tutti questi microrganismi aiutano a mantenere l’igiene orale impedendo ai tipi patogeni di attaccarsi alla superficie della mucosa, colonizzandola (34).
LA FORMAZIONE DEL BIOFILM DENTALE
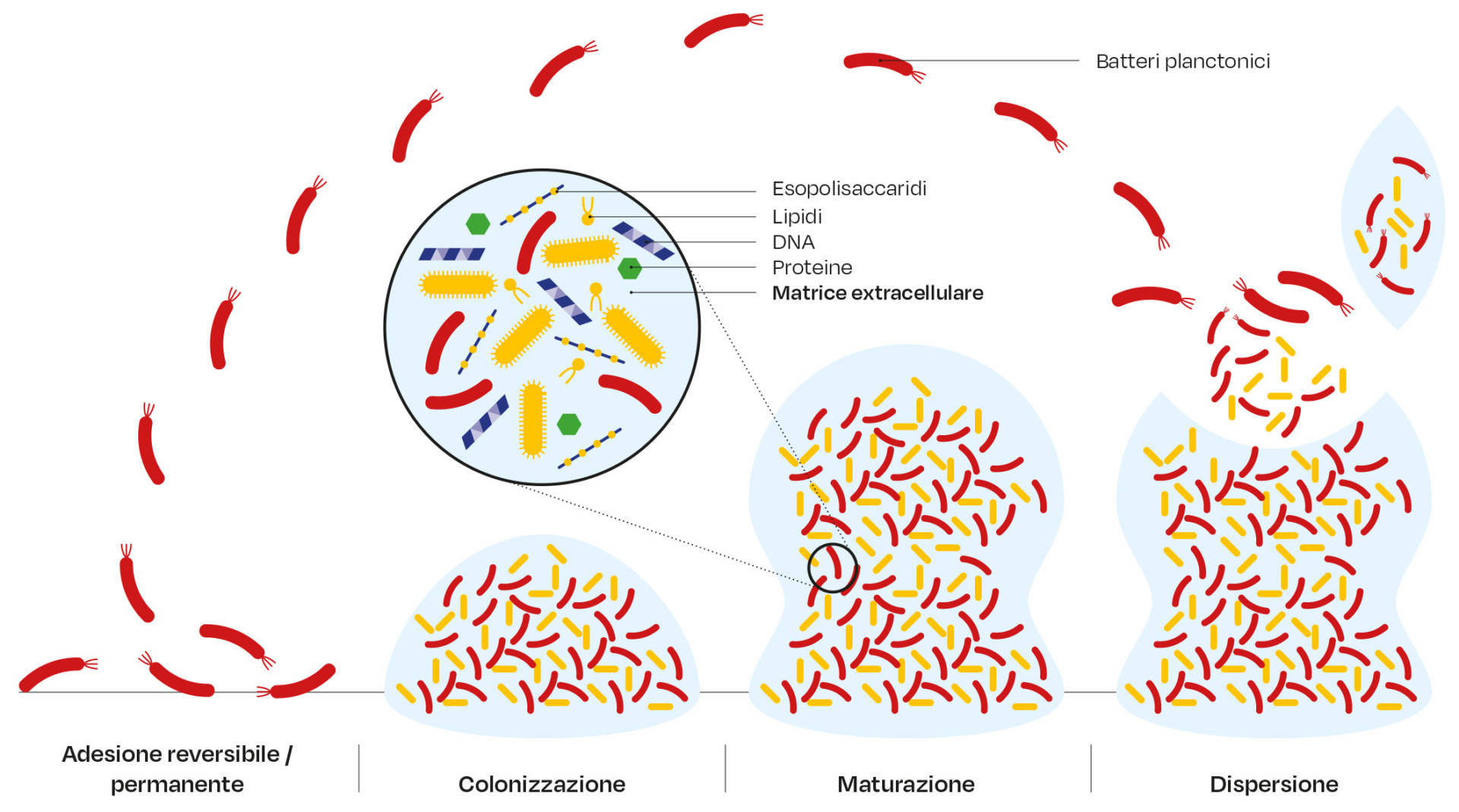
La formazione del biofilm dentale inizia immediatamente dopo la pulizia della superficie del dente, con l’adsorbimento di un film organico, la pellicola, che funge da ligando per i vari recettori batterici (35). Una prima parte dei batteri inizialmente stabilisce un contatto diretto con la superficie della pellicola, mentre i successivi batteri colonizzatori aderiranno ai batteri già attaccati un fenomeno chiamato coadesione, o a diversi componenti della matrice extracellulare. La tipologia di microbiota che per prima colonizza nel biofilm è dominato da specie streptococciche (36, 37) ed è stato dimostrato che se il biofilm dentale viene lasciato indisturbato, esso va incontro a una maturazione del microbiota. Durante questo processo la composizione dei batteri nel biofilm subisce una trasformazione nel senso che da un primo microbiota dominato da cocchi gram-positivi si passa ad un microbiota composto da cocchi, organismi filamentosi, spirochete e un maggior numero di batteri gram-negativi. L’acquisizione di batteri e la maturazione del microbiota presente del biofilm induce lo sviluppo della gengivite (38), una infiammazione che, se trascurata, risulta prodromica della parodontite (detta anche malattia parodontale o periodontite o parodontopatia o, volgarmente, piorrea), come pure confermato attraverso l’utilizzo di tecniche molecolari (39,40).
La coaggregazione, cioè l’adesione di batteri geneticamente distinti tra loro, svolge un ruolo fondamentale nella formazione del biofilm dentale ed è un fenomeno diffuso tra i batteri presenti nella cavità orale (41-43), favorendo la colonizzazione dei batteri che si aggiungono tardivamente al resto del preesistente microbiota. Gli ultimi colonizzatori potrebbero non coaggregare direttamente con le prime specie colonizzatrici, ma potrebbero farlo con ceppi di batteri Gram-negativi come il Fusobacterium nucleatum, un batterio che è stato riferito essere in grado di coaggregare sia con i primi colonizzatori sia con gli ultimi colonizzatori (41, 44). I batteri possono, comunque, anche staccarsi dal biofilm andando incontro a una dispersione, un processo passivo o attivo processo mediato dagli stessi batteri. Così, la dispersione dal biofilm consente ai batteri di colonizzarne nuovi siti nella cavità orale (45). Da notare che lo stretto contatto tra i batteri, nel biofilm orale, consente interazioni sia sinergiche che antagonistiche (46).
Non di meno, la cooperazione nutrizionale è una caratteristica importante dei biofilm orali, con conseguente generazioni di catene alimentari e reti nutrizionali all’interno del microbiota. Inoltre, i batteri possono cooperare tra di loro per metabolizzare molecole salivari (47). Come è stato evidenziato, la capacità metabolica di un batterio contribuisce a dettare la sua posizione spazio-temporale nel biofilm dentale (48). In ogni caso, subito dopo aver aderito alla superficie, i batteri iniziano a produrre una matrice extracellulare composta da polisaccaridi (esopolisaccaridi), lipidi, proteine e DNA extracellulari. Questa matrice è essenziale per l’architettura del biofilm, come pure per l’integrità e le proprietà caratteristiche del biofilm, compresa una maggiore tolleranza nei confronti di composti antimicrobici (5, 49).
L’importanza dei polisaccaridi nella costituzione e produzione di biofilm orali, nonché l’associazione tra biofilm orali e carie dentale, sono state riconosciute già oltre mezzo secolo fa (50). In ogni caso, la produzione degli esopolisaccaridi extracellulari, sia solubili che insolubili, da parte di glucosiltransferasi batteriche si è riscontrata essere responsabile dell’adesione di Streptococcus mutans alle superfici dei denti, come pure della cariogenicità (50). Da porre in evidenza che la presenza di Streptococcus mutans promuove la colonizzazione da parte di alcuni lattobacilli (51) sia attraverso il legame con le glucosiltrasferasi sia attraverso un meccanismo di adesione mediato dal glucano, aumentando così l’accumulo di entrambi gli organismi all’interno dei biofilm. Inoltre, in aggiunta alla produzione di polisaccaridi extracellulari, si presume che le glucosiltransferasi vengano utilizzate anche per glicosilare importanti proteine implicate nell’adesione batterica e nella formazione del biofilm (24, 52).
Come dimostrato da una serie di studi in vitro e da campioni ex vivo, il DNA extracellulare può svolgere un ruolo importante in seno alla matrice extracellulare del biofilm dentale come dei biofilm orali (21). In tale contesto, la stretta vicinanza di batteri in un biofilm può consentire un aumento delle frequenze del trasferimento genico orizzontale (53); inoltre, è stato osservato che negli streptococchi del cavo orale, può verificarsi una ricombinazione sia intraspecie sia interspecie (54-56). La Figura 2 mostra le principali fasi della formazione di un biofilm.
IL CONTROLLO DEL BIOFILM DENTALE: UNA BREVE RASSEGNA
Il controllo del biofilm orale incide notevolmente sulle spese sanitarie in tutto il mondo (57). In ogni caso, con il recente boom di nuove tecnologie e una maggiore conoscenza delle componenti genetiche, delle risposte fisiologiche e intracellulari, come pure delle vie di trasduzione del segnale, la comprensione dei biofilm ha progredito in modo significativo rispetto alla metà degli anni ’80 quando per la prima volta si cominciò a definire il biofilm dentale (58). Come noto, l’accumulo di biofilm sottogengivali avvia lo sviluppo di evidenti segni clinici di gengivite (59).
In tale contesto, in seguito alle complesse interazioni tra i biofilm sottogengivali e la risposta immunitaria dell’ospite, la gengivite può evolvere ulteriormente in parodontite con concomitante perdita dei tessuti parodontali di supporto (60-62).
Gli approcci terapeutici parodontali si basano prima di tutto sulla rimozione completa dei biofilm sottogengivali e dei depositi di tartaro, ma possono anche comprendere l’uso aggiuntivo di antimicrobici, applicati come medicazioni locali o sistemiche (63). A tale riguardo, sebbene il più delle volte, e come primo approccio, la rimozione meccanica dei biofilm sottogengivali mostri risultati clinici positivi in termini di riduzione della profondità del biofilm, lo stesso approccio si rivela ancora un arduo lavoro in un ambiente clinico. Infatti, i biofilm sono generalmente in grado di resistere alle sollecitazioni meccaniche grazie sostanzialmente alla protezione fisica fornita dalla matrice del biofilm, e in particolare dai suoi componenti esopolisaccaridici (28, 49) prodotti dagli stessi batteri. La rimozione dei biofilm può quindi essere ottenuta solo superando una serie di forze coesive e adesive presenti nella matrice del biofilm (49).
Per quanto concerne la terapia antimicrobica, in aggiunta alla rimozione meccanica del biofilm, diverse classi distinte di agenti antimicrobici vengono abitualmente utilizzate nella pratica clinica, sia nei prodotti per l’igiene orale per uso domestico sia nel corso di un trattamento parodontale professionale (64, 65). Pertanto, di recente, in considerazione delle crescenti minacce derivanti dalla resistenza antimicrobica, sono stati proposti approcci antimicrobici alternativi, come la terapia fotodinamica antimicrobica (66). Di certo, le proprietà viscoelastiche di un biofilm possono svolgere un ruolo importante non solo nella sua stabilità meccanica, ma anche per quanto riguarda la penetrazione degli antimicrobici all’interno della struttura (67). Un altro fattore importante per quanto riguarda l’aumentata tolleranza dei batteri del biofilm nei confronti degli antimicrobici è la loro inattivazione da parte di enzimi rilasciati da batteri lisati ovvero da batteri del biofilm (68, 69).
Tra le nuove strategie per la distruzione o inibizione del biofilm orale, di cui qualcuna già citata in precedenza, vanno annoverate:
a) la terapia fotodinamica;
b) i nanomateriali;
c) la terapia genica;
d) gli inibitori della glucansaccarasi;
e) i sali di ammonio quaternario;
f) i probiotici;
g) l’arginina;
h) i prodotti naturali.
a) La terapia fotodinamica.
Seppure diversi studi abbiano dimostrato che alcuni batteri legati alla malattia parodontale hanno la capacità di produrre intrinsecamente una sostanza fotosensibile, come la protoporfirina IX, la maggior parte dei batteri non produce composti fotosensibili endogeni. Pertanto, le cellule prive di questi composti possono diventare sensibili alla luce solo quando viene aggiunta una molecola fotosensibilizzante esogena (70, 71). Il meccanismo d’azione della terapia fotodinamica si manifesta quando la sostanza fotosensibile (intrinseca o estrinseca) viene esposta a una particolare lunghezza d’onda, emessa da una sorgente luminosa, e idonea ad attivare la molecola fotosensibile. Attraverso questo processo si formeranno composti capaci di svolgere un’azione antimicrobica, come le specie reattive dell’ossigeno (ROS: reactive oxygen species), il perossido di idrogeno, il radicale ossidrile e l’ossigeno singoletto. Studi clinici hanno dimostrato che questa terapia è abbastanza efficace come coadiuvante nel trattamento della malattia parodontale (66, 72); tuttavia, affinché questa terapia abbia successo, devono essere presi in considerazione diversi parametri, quali il fotosensibilizzante utilizzato, la sua concentrazione, la lunghezza d’onda e il tempo di irradiazione, di conseguenza, dovrebbero essere sviluppati, di volta in volta, protocolli clinici appositamente mirati, caso per caso.
b) I nanomateriali.
Sin dalla loro scoperta negli anni ‘80, questi tipi di composti hanno rivoluzionato il concetto di che cosa possa essere, o come possa essere definito, un materiale. Da allora, i nanomateriali sono stati impiegati in molti campi compresa la medicina e si prevede che avranno ampie prospettive per lo sviluppo futuro (73). Molti nanomateriali, a base di argento, ossido di rame, ossido di zinco, ossido di titanio e grafene, possono essere utilizzati per controllare la formazione di biofilm (74-76). Inoltre, l’ammonio quaternario, il chitosano e anche le nanoparticelle di silice sono state suggerite come essere efficaci nel controllo dei biofilm (77, 78). In aggiunta, l’utilizzo di nanomateriali per la somministrazione di farmaci sia come vettore con affinità specifica per le superfici dei denti o come farmaco per le sue intrinseche proprietà antimicrobiche -, ha attirato l’attenzione nei recenti anni (77, 79, 80). Tra i nanomateriali che hanno mostrato una evidente capacità nel controllo del biofilm orale, vanno annoverati il nitrato d’argento e le nanoparticelle d’argento (AgNP) che sono risultati essere i più efficaci contro i patogeni orali (81). Tuttavia, in alcuni casi si è visto che il nitrato d’argento, usato come tale, può causare la decolorazione della dentina (82, 83).
c) La terapia genica.
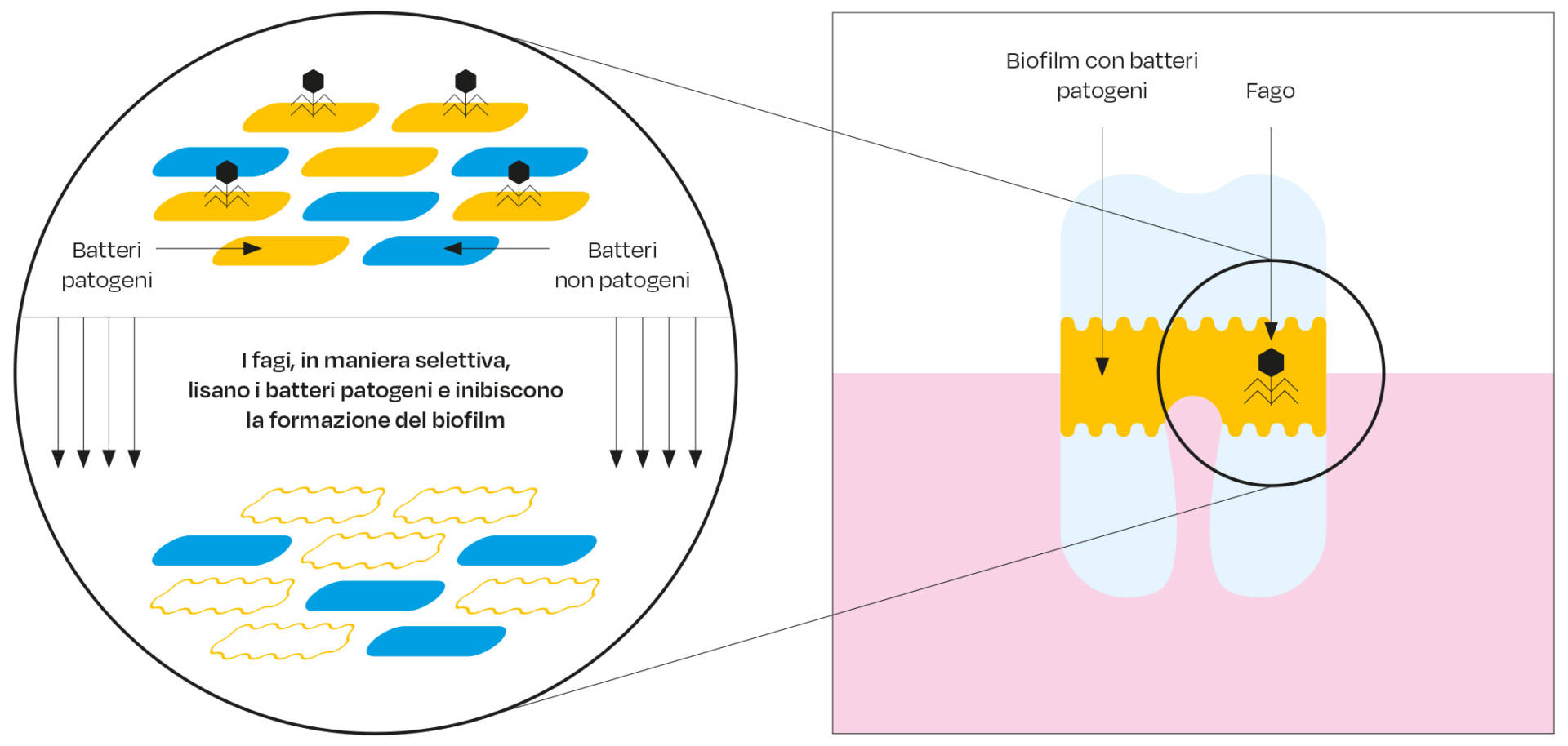
I fagi sono proteine che incapsulano il DNA e l’acido ribonucleico (RNA) e producono enzimi idrolitici che decompongono la struttura del biofilm a livello della carie dentale. Inoltre, sradicano o riducono al minimo i batteri che crescono nel biofilm e quindi esercitano il loro effetto battericida impedendo un’ulteriore replicazione e quindi inibendo la propagazione in tutto il biofilm (84). I fagi sono specifici per i batteri patogeni con un impatto minimo sui batteri probiotici e sui tessuti sani (85) come illustrato in Figura 3. Inoltre, i fagi vanno incontro a una rapida mutazione e propagazione con maggiori possibilità di uccidere i batteri più velocemente attraverso un ben definito e distinto meccanismo d’azione; di certo, riguardo alla loro azione battericida, risultano essere di gran lunga migliori rispetto agli altri antimicrobici e antibiotici (86).
d) Gli inibitori della glucansaccarasi.
La glucansaccarasi è un enzima secreto dallo Streptococcus mutans, un batterio essenziale per la manifestazione della patogenicità batterica nella carie dentale. La glucansaccarasi scinde, mediante una reazione di idrolisi, il saccarosio, un disaccaride non riducente, nelle sue due componenti monosaccaridiche: fruttosio e glucosio. Quest’ultimo viene abbondantemente utilizzato per la produzione di strutture a catena, polimeriche, presenti nel biofilm. Quindi, l’inibizione di questo enzima può impedire la realizzazione di queste lunghe catene polimeriche e, a sua volta, impedire la formazione del biofilm, un tipico costituente della carie dentale (87). In aggiunta, la glucansaccarasi oltre a idrolizzare il saccarosio, è in grado di svolgere un’azione transferasica trasportando le unità glucosidiche su una qualche molecola accettrice (88).
e) I sali di ammonio quaternario.
Policationi, come i sali d’ammonio quaternario (QAS), sono ad alto peso molecolare, non volatili, chimicamente stabili. Grazie al loro ampio spettro di attività antimicrobica e al basso livello di tossicità, sono stati utilizzati per la prima volta negli anni ‘70 nei collutori per controllare il biofilm orale. Successivamente, negli anni ‘90, i QAS sono stati aggiunti ai materiali compositi dentali (89, 90). Il meccanismo antibatterico dei QAS è da attribuire alla loro carica positiva che interagendo con la membrana cellulare caricata negativamente, causa la lisi del batterio (91). Alcuni tipi di QAS presentano gruppi reattivi attivi situati in entrambe le estremità della struttura e possono essere incorporati anche nelle resine senza comprometterne le proprietà meccaniche (92). Ad ogni modo, un uso frequente dei QAS può contribuire a far sì che i batteri possano acquisire la resistenza verso gli antibiotici (93).
f) I probiotici.
I probiotici, costituiti essenzialmente da microrganismi viventi, sono benefici per gli ospiti se somministrati in quantità adeguate come integratori alimentari. Essi potrebbero presentarsi sotto forma di batteri, muffe o lieviti (94) e possono agire in maniera diretta o indiretta. L’attività diretta comporta il legame al biofilm, stabilendo così una competizione con i batteri residenti nel biofilm per l’utilizzo dei substrati metabolici producendo, nello stesso tempo, sostanze inibitrici della crescita batterica. L’azione indiretta comporta un aumento e un miglioramento sia della risposta immunitaria sia dei sistemi di difesa non-immunologici, nonché una diminuzione della permeabilità delle mucose da parte dei batteri (95). In generale i probiotici hanno mostrato una certa potenzialità nell’applicazione topica a livello del cavo orale, grazie all’effetto localizzato dei vari microrganismi costituenti lo specifico probiotico (96). Ciononostante, per una migliore applicazione topica dei probiotici sono richiesti ulteriori dati clinici e valutazioni specialmente sulle diverse modalità di dosaggio.
g) L’arginina.
L’urea e l’arginina sono i due substrati principali per la generazione di alcali nel biofilm orale. Alcuni commensali sono in grado di produrre composti alcalini per contrastare lo stress acido imposto da batteri acidogenici come Streptococcus mutans e mantenere sano il biofilm orale (97, 98). I commensali orali producono principalmente alcali attraverso le vie del metabolismo dell’arginina e dell’urea (99). Una via prevalente del metabolismo dell’arginina coinvolge il sistema arginina deiminasi (ADS), producendo ornitina, ammoniaca, CO2 e ATP (97, 99). Streptococchi orali, incluso S. sanguinis, S. gordonii, S. parasanguinis, S. intermedius, S. cristatus e S. australis, come pure alcune specie di Lactobacillus e certe spirochete possono esprimere l’ADS (99). Pertanto, utilizzando dentifrici contenenti arginina l’attività ADS nella placca di individui carie-attiva può aumentare significativamente, in maniera tale da ottenere una composizione dei batteri simile a quella degli individui senza carie (100, 101).
Inoltre, l’arginina sopprime la produzione e la composizione dei glucani della membrana extracellulare, quindi, tra l’altro, inibisce l’adesione di S. mutans sulla superficie del dente (102). Di più importante, l’uso combinato di arginina e sodio fluoruro (NaF) potrebbe inibire in modo sinergico la crescita sia di S. mutans sia di Porphyromonas gingivalis offrendo così un approccio ecologico al controllo del biofilm orale (103).
h) I prodotti naturali.
Anche se la loro struttura può essere incerta, i prodotti naturali esibiscono attività biologiche che li rendono, rispetto al biofilm orale, promettenti agenti nelle terapie alternative o aggiuntive (104). In tale contesto, una particolare attenzione va riservata ai polifenoli che sono definiti come una qualsiasi sostanza che contiene almeno un anello aromatico con uno o più gruppi idrossilici e altri sostituenti che rendono attivi questi composti presenti in molti prodotti naturali come il tè, il propoli, il mirtillo rosso, la Galla chinensis, l’uva, il caffè e il cacao (105-107). In generale, questi composti riducono la formazione del biofilm, nonché l’aderenza e l’infettività di molte specie batteriche presenti nel biofilm (108, 109). In altri casi svolgono un vero e proprio effetto antibatterico (110).
IL BIOFILM NELLA SALUTE DELLE GENGIVE E NELLO SVILUPPO DELLA PARODONTITE
Il microbiota del biofilm nella salute gengivale
La buona salute delle gengive è legata anche a una disposizione molto semplice della placca sopragengivale, inclusi i vari strati (da 1 a circa 20) di batteri principalmente Gram-positivi e, in misura minore, anche specie Gram-negative (111). Nello stato di buona salute, la microflora del solco gengivale è molto scarsa, con gli streptococchi Gram-positivi che predominano (112). In generale i primi batteri colonizzatori sono organismi in grado di sopportare le elevate concentrazioni di ossigeno e resistere ai diversi meccanismi della loro eliminazione dalla cavità orale come deglutire, masticare, soffiarsi il naso, salivare, versamento del liquido crevicolare (113). La proliferazione di questi batteri permette la successiva adesione di altre specie batteriche che, tuttavia, non sono in grado di attaccarsi direttamente alle superfici dure di denti, ma possono attaccarsi, secondo la cosiddetta “colonizzazione secondaria”, solo a microrganismi preesistenti. Con l’aumentare degli strati di placca, si generano altri livelli o piani nutrizionali e atmosferici, così quando la quantità di ossigeno diminuisce, specialmente nei livelli sottostanti, gli anaerobi possono proliferare e continuare a vivere (114, 115).
La gengivite clinica è accompagnata dall’evoluzione di una placca dentale diversamente riarrangiata sia da un punto di vista metabolico sia da un punto di vista della disponibilità di ossigeno, generando biofilm di diversa composizione molecolare e batterica (116, 117). Di conseguenza, diminuendo la quantità di ossigeno, una buona parte di streptococchi Gram-positivi, un indice di buona salute delle gengive, viene rimpiazzata con cocchi Gram-negativi e anaerobici come ad esempio Fusobacterium nucleatum, Campylobacter gracilis, Bacteroides forsythus, e specie di Capnocytophaga (118). Di norma, la gengivite si manifesta prima della parodontite. Comunque, il passaggio dalla gengivite alla parodontite non avviene automaticamente, infatti, in ogni paziente o anche in ogni sito, si basa principalmente sulla sensibilità dell’ospite e sulle tipologie di specie di batteri patogeni e non patogeni (119). Pertanto, i batteri mantengono caratteristiche borderline che riducono l’efficacia della risposta da parte dell’ospite, innescando il deterioramento dei tessuti e prevenendo il recupero degli stessi (120).
Biofilm e sviluppo della parodontite
Nella malattia infiammatoria che prende il nome di parodontite viene coinvolta la totalità dei tessuti di sostegno del dente che consistono nell’osso alveolare, nella gengiva e nel legamento periodontale, tessuti che nel loro insieme sono riconosciuti come il parodonto
(121). La parodontite potrebbe non solo indurre la perdita dei denti, ma potrebbe anche modificare ulteriormente la salute fisica aumentando il rischio di aterosclerosi, artrite reumatoide, polmonite ab ingestis, esiti avversi della gravidanza e cancro (122). La parodontite da biofilm è complessa e coinvolge molti strati cellulari.
In base alle loro caratteristiche di virulenza e una forte relazione con le parti coinvolte nella malattia, tre batteri anaerobici orali quali Porphyromonas gingivalis, Treponema denticola e Tannerella forsythia sono stati convenzionalmente considerati come i principali fattori causali della parodontite (123). In particolare, in una placca dentale patogenica prevale la presenza di Porphyromonas gingivalis e Treponema denticola, batteri che contribuiscono a un inspessimento della placca e a un maggior sanguinamento dalle gengive (124).
I dati che sono stati ottenuti recentemente sostengono che i vari microbioti associati alla parodontite contribuiscono all’evolversi della malattia più di quanto si pensasse in precedenza. Nel modello suggerito, la malattia non ha origine da un singolo patogeno, ma da un’interazione cooperativa polimicrobica e disbiosi che incidono negativamente sul biofilm il quale, quando ecologicamente stabile, risulta correlato alla normale omeostasi del tessuto parodontale (60, 125).
Conflitto di interesse
L’autore dichiara nessun conflitto di interesse. Il presente studio è stato finanziato con fondi RIA 2022 (MIUR, Roma).
- Wade WG. The oral microbiome in health and disease. Pharmacol Res 2013; 69:137-43.
- Costerton JW. Week’s Citation Classic in Current Contents/Clinical Medicine 1989; 48:18.
- Belibasakis GN. Microbiological changes of the ageing oral cavity. Arch Oral Biol 2018; 96:230-2.
- Kassebaum NJ, et al. Global, regional, and national prevalence, incidence, and disability-adjusted life years for oral conditions for 195 countries, 1990–2015: a systematic analysis for the global burden of diseases, injuries, and risk factors. J Dent Res 2017; 96:380-7.
- Flemming HC, et al. Biofilms: an emergent form of bacterial life. Nat Rev Microbiol 2016; 14:563–75.
- Hobley L, et al. Giving structure to the biofilm matrix: an overview of individual strategies and emerging common themes. FEMS Microbiol Rev 2015; 39:649-69.
- Koo H, Yamada KM. Dynamic cell-matrix interactions modulate microbial biofilm and tissue 3D microenvironments. Curr Opin Cell Biol 2016; 42:102-12.
- David LA, et al. Diet rapidly and reproducibly alters the human gut microbiome. Nature 2014; 505:559-63.
- Maslowski KM, Mackay CR. Diet, gut microbiota and immune responses. Nat Immunol 2011; 12:5-9.
- Takahashi N, Nyvad B. The role of bacteria in the caries process: ecological perspectives. J Dent Res 2011; 90:294-303.
- Pitts NB, et al. Dental caries. Nat Rev Dis Primers 2017; 3:17030.
- Adler CJ, et al. Sequencing ancient calcified dental plaque shows changes in oral microbiota with dietary shifts of the Neolithic and Industrial revolutions. Nat Genet 2013; 45:450-5.
- Lebeaux D, et al. Biofilm-related infections: bridging the gap between clinical management and fundamental aspects of recalcitrance toward antibiotics. Microbiol Mol Biol Rev 2014; 78:510-43.
- Mira A, et al. Role of microbial communities in the pathogenesis of periodontal diseases and caries. J Clin Periodontol 2017; 44:S23–S38.
- Dewhirst FE. The oral microbiome: critical for understanding oral health and disease. J Calif Dent Assoc 2016; 44:409-10.
- Koo H, et al. The exopolysaccharide matrix: a virulence determinant of cariogenic biofilm. J Dent Res 2013; 92:1065-73.
- Hall-Stoodley L, Stoodley P. Evolving concepts in biofilm infections. Cell Microbiol 2009; 11:1034-43.
- Van Acker H, et al. Molecular mechanisms of antimicrobial tolerance and resistance in bacterial and fungal biofilms. Trends Microbiol 2014; 22:326-33.
- Lamont RJ, Hajishengallis G. Polymicrobial synergy and dysbiosis in inflammatory disease. Trends Mol Med 2015; 21:172-83.
- Bowen WH, Koo H. Biology of Streptococcus mutans-derived glucosyltransferases: role in extracellular matrix formation of cariogenic biofilms. Caries Res. 2011; 45:69-86.
- Rostami N, et al. A critical role for extracellular DNA in dental plaque formation. J Dent Res 2017; 96:208-16.
- Besingi RN, et al. Functional amyloids in Streptococcus mutans, their use as targets of biofilm inhibition and initial characterization of SMU_63c. Microbiology 2017; 163:488-501.
- Klein MI, et al. Streptococcus mutans-derived extracellular matrix in cariogenic oral biofilms. Front Cell Infect Microbiol 2015; 5:10.
- Zhu F, et al. Glycosyltransferase- mediated sweet modification in oral streptococci. J Dent Res 2015; 94:659-65.
- Xiao J, et al. The exopolysaccharide matrix modulates the interaction between 3D architecture and virulence of a mixed-species oral biofilm. PLoS Pathog. 2012; 8:e1002623.
- Mark Welch JL, et al. Biogeography of a human oral microbiome at the micron scale. Proc Natl Acad Sci USA. 2016; 113:791-800.
- Stacy A, et al. The biogeography of polymicrobial infection. Nat Rev Microbiol 2016; 14:93-105.
- Peterson BW, et al. Viscoelasticity of biofilms and their recalcitrance to mechanical and chemical challenges. FEMS Microbiol Rev 2015; 39:234-45.
- Guilhen C, et al. Biofilm dispersal: multiple elaborate strategies for dissemination of bacteria with unique properties. Mol Microbiol 2017; 105:188-210.
- Liu Y, et al. Topical delivery of low- cost protein drug candidates made in chloroplasts for biofilm disruption and uptake by oral epithelial cells. Biomaterials 2016; 105:156-66.
- Dominguez-Bello MG, et al. Role of the microbiome in human development. Gut 2019; 68:1108-14.
- Filoche S, et al. Oral biofilms: emerging concepts in microbial ecology. J Dent Res 2010; 89:8-18.
- Kuang X, et al. Novel approaches to the control of Oral microbial biofilms. BioMed Res Int 2018; 2018:6498932.
- Štšepetova J, et al. Impact of polyols on oral microbiome of estonian schoolchildren. BMC Oral Health 2019; 19:60.
- Scheie AA. Mechanisms of dental plaque formation. Adv Dent Res 1994; 8:246-53.
- Tinanoff N, et al. Development of plaque on enamel. Parallel investigations. J Periodontal Res 1976; 11:197-209.
- Nyvad B, Kilian M. Microbiology of the early colonization of human enamel and root surfaces in vivo. Scand J Dent Res 1987; 95:369-80.
- Theilade E, et al. Experimental gingivitis in man. II. A longitudinal clinical and bacteriological investigation. J Periodontal Res 1966; 1:1-13.
- Kistler JO, et al. Bacterial community development in experimental gingivitis. PLoS ONE 2013; 8:e71227.
- Haffajee AD, et al. Factors affecting human supragingival biofilm composition. I. Plaque mass. J Periodontal Res 2009; 44:511-9.
- Kolenbrander PE, London J. Adhere today, here tomorrow: oral bacterial adherence. J Bacteriol 1993; 175:3247-52.
- Kolenbrander PE. Surface recognition among oral bacteria: multigeneric coaggregations and their mediators. Crit Rev Microbiol 1989; 17:137-59.
- Palmer RJ Jr, et al. Interbacterial adhesion networks within early oral biofilms of single human hosts. Appl Environ Microbiol 2017; 83:e00407– e00417.
- Kolenbrander PE, et al. Coaggregation of Fusobacterium nucleatum, Selenomonas flueggei, Selenomonas infelix, Selenomonas noxia, and Selenomonas sputigena with strains from 11 genera of oral bacteria. Infect Immun 1989; 57:3194-203.
- Kaplan JB. Biofilm dispersal: mechanisms, clinical implications, and potential therapeutic uses. J Dent Res 2010; 89:205-18.
- Marsh PD, Zaura E. Dental biofilm: ecological interactions in health and disease. J Clin Periodontol 2017; 44:S12-S22.
- Jakubovics NS. Saliva as the sole nutritional source in the development of multispecies communities in dental plaque. Microbiol Spectr 2015; 3:MBP- 0013-2014.
- Mazumdar V, et al. Metabolic proximity in the order of colonization of a microbial community. PLoS ONE 2013; 8:e77617.
- Flemming HC, Wingender J. The biofilm matrix. Nat Rev Microbiol 2010; 8:623-33.
- Gibbons RJ. Formation and significance of bacterial polysaccharides in caries etiology. Caries Res 1968; 2:164-71.
- Wen ZT, et al. Biofilm formation and virulence expression by Streptococcus mutans are altered when grown in dual-species model. BMC Microbiol. 2010; 10:111.
- Zhu F, et al. Engineering and dissecting the glycosylation pathway of a streptococcal serine-rich repeat adhesin. J Biol Chem 2016; 291:27354-63.
- Madsen JS, et al. The interconnection between biofilm formation and horizontal gene transfer. FEMS Immunol Med Microbiol 2012; 65:183-95.
- Do T, et al. Clonal structure of Streptococcus sanguinis strains isolated from endocarditis cases and the oral cavity. Mol Oral Microbiol 2011; 26:291-302.
- Chi F, et al. Crossing the barrier: evolution and spread of a major class of mosaic pbp2x in Streptococcus pneumoniae, S. mitis and S. oralis. Int J Med Microbiol 2007; 297:503-12.
- Hoshino T, et al. Use of phylogenetic and phenotypic analyses to identify nonhemolytic streptococci isolated from bacteremic patients. J Clin Microbiol 2005; 43:6073-85.
- Beikler T, Flemmig TF. Oral biofilm-associated diseases: Trends and implications for quality of life, systemic health, and expenditures. Periodontology 2011; 55:87-103.
- Liang Y, et al. Current understanding of multi-species biofilms. Int J Oral Sci 2011; 3:74-81.
- Jakubovics NS, et al. The dental plaque biofilm matrix Periodontol 2000. 2021; 86:32-56.
- Darveau RP. Periodontitis: a polymicrobial disruption of host homeostasis. Nat Rev Microbiol 2010; 8:481-90.
- Kilian M, et al. The oral microbiome - an update for oral healthcare professionals. Br Dent J 2016; 221:657-66.
- Meyle J, Chapple I. Molecular aspects of the pathogenesis of periodontitis. Periodontol 2000. 2015;69:7-17.
- Flemmig TF, Beikler T. Control of oral biofilms. Periodontol 2000. 2011;55:9-15.
- Jepsen K, Jepsen S. Antibiotics/ antimicrobials: systemic and local administration in the therapy of mild to moderately advanced periodontitis. Periodontol 2000. 2016; 71:82-112.
- Sanz M, et al. Antiplaque and antigingivitis toothpastes. Monogr Oral Sci 2013; 23:27-44.
- Cieplik F, et al. Antimicrobial photodynamic therapy—what we know and what we don’t. Crit Rev Microbiol 2018; 44:571-89
- He Y, et al. Stress relaxation analysis facilitates a quantitative approach towards antimicrobial penetration into biofilms. PLoS One. 2013; 8:e63750.
- Høiby N, et al. Antibiotic resistance of bacterial biofilms. Int J Antimicrob Agents 2010; 35:322-32.
- Mah TF, O’Toole GA. Mechanisms of biofilm resistance to antimicrobial agents. Trends Microbiol 2001; 9:34-9.
- Wilson M, et al. Sensitization of oral bacteria to killing by low power laser radiation. Curr Microbiol 1992; 25:77-81.
- Wilson M. Photolysis of oral bacteria and its potential use in the treatment of caries and periodontal disease. J Appl Bacteriol 1993; 75:299-306.
- Rosa EP et al. Efficacy of photodynamic therapy and periodontal treatment in patients with gingivitis and fixed orthodontic appliances. Medicine 2020; 99:e19429.
- J. Hulla J, et al. Nanotechnology: History and future. Hum Exp Toxicol 2015; 34:1318-21.
- Allaker RP, Memarzadeh K. Nanoparticles and the control of oral infections. Int J Antimicrob Agents 2014; 43:95-104.
- Hemeg HA. Nanomaterials for alternative antibacterial therapy. Int J Nanomedicine 2017; 12:8211-25.
- Rai MK, et al. Silver nanoparticles: the powerful nanoweapon against multidrug-resistant bacteria. J Appl Microbiol 2012; 112:841-52.
- Besinis A, et al. Review of nanomaterials in dentistry: interactions with the oral microenvironment, clinical applications, hazards, and benefits. ACS Nano 2015; 9:2255-89.
- Shrestha A. et al. Nanoparticulates for antibiofilm treatment and effect of aging on its antibacterial activity. J Edond 2010; 36:1030-5.
- Hannig M, Hannig C. Nanomaterials in preventive dentistry. Nat Nanotechnol 2010; 5:565-9.
- Cheng L. et al. Nanotechnology strategies for antibacterial and remineralizing composites and adhesives to tackle dental caries. Nanomedicine 2015; 10:627-41.
- Besinis A, et al. The antibacterial effects of silver, titanium dioxide and silica dioxide nanoparticles compared to the dental disinfectant chlorhexidine on Streptococcus mutans using a suite of bioassays. Nanotoxicology 2014; 8:1-16.
- Peng JJY, et al. Silver compounds used in dentistry for caries management: a review. J Dent 2012; 40:531-41.
- Kumar A. et al. Drug induced discoloration of teeth: An updated review. Clin Pediatr 2012; 51:181-5.
- Kasimanickam RK, et al. Prevention and treatment of biofilms by hybrid- and nanotechnologies. Int J Nanomed 2013; 8:2809-19.
- Burrowes B, et al. Bacteriophage therapy: potential uses in the control of antibiotic-resistant pathogens. Expert Rev Anti-Infect Ther 2011; 9:775-85.
- Khalifa L, et al. Phage therapy against Enterococcus faecalis in dental root canals. J Oral Microbiol 2016; 8:10.3402
- Ito K, et al. Crystal structure of glucansucrase from the dental caries pathogen Streptococcus mutans. J. Mol. Biol. 2011; 408:177-86.
- Monchois V, et al. Glucansucrases: mechanism of action and structure- function relationships. FEMS Microbiol Rev 1999; 23:131-51.
- Ciancio SG, et al. Clinical evaluation of a quaternary ammonium containing mouthrinse. J Periodontol 1975; 46:397-401.
- Liang JG, et al. The anti-caries effects of dental adhesive resin influenced by the position of functional groups in quaternary ammonium monomers. Dent Mater 2018; 34:400-11.
- Beyth N, et al. Antibacterial activity of dental composites containing quaternary ammoniumpolyethylenimine nanoparticles against Streptococcus mutans. Biomaterials 2006; 27:3995-4002.
- Cheng L, et al. Anti-biofilm dentin primer with quaternary ammonium and silver nanoparticles. J Dent Res 2012; 91:598-604.
- Hegstad K, et al. Does the wide use of quaternary ammonium compounds enhance the selection and spread of antimicrobial resistance and thus threaten our health? Microb Drug Resist, 2010; 16:91-104.
- Chatterjee A, et al. Probiotics in periodontal health and disease. J Indian Soc Periodontol 2011, 15:238.
- Meurman JH. Probiotics: do they have a role in oral medicine and dentistry? Eur. J. Oral Sci. 2005; 113:188-96.
- Trinette F, et al. Current and novel approaches for control of dental biofilm. Int J Pharm 2018; 536:199-210.
- Bowen WH, et al. Oral biofilms: pathogens, matrix, and polymicrobial interactions in microenvironments. Trends Microbiol 2018; 26:229-42.
- He J, et al. L-Arginine modifies the exopolysaccharide matrix and thwarts Streptococcus mutans outgrowth within mixed-species oral biofilms. J Bacteriol 2016; 198:2651-61.
- Burne RA, Marquis RE. Alkali production by oral bacteria and protection against dental caries. FEMS Microbiol Lett 2000; 193:1-6.
- Nascimento MM et al. The effect of arginine on oral biofilm communities. Mol Oral Microbiol 2014; 29:45-54.
- Zheng X, et al. Ecological effect of arginine on oral microbiota. Sci Rep 2017; article 7206.
- Sharma S, et al. Nanoscale characterization of effect of L-arginine on Streptococcus mutans biofilm adhesion by atomic force microscopy. Microbiology 2014; 160:1466-73.
- Zheng X, et al. Combinatorial effects of arginine and fluoride on oral bacteria. J Dent Res 2015; 94:344-53.
- Jeon JG et al. Natural products in caries research: current (limited) knowledge, challenges and future perspective. Caries Res 2011; 45:243-63.
- Yoo S, et al. Antimicrobial traits of tea- and cranberry-derived polyphenols against streptococcus mutans. Caries Res 2011; 45:327-35.
- Cheng L, et al. Natural products and caries prevention. Caries Res 2015; 49:38-45.
- Gazzani G, et al. Food components with anticaries activity. Curr Opin Biotechnol 2012; 23:153-9.
- La VD, et al. Anti-Porphyromonas gingivalis and anti-inflammatory activities of A-type cranberry proanthocyanidins. Antimicrob Agents Chemother 2010; 54:1778-84.
- Labrecque J, et al. Effects of a high-molecular-weight cranberry fraction on growth, biofilm formation and adherence of Porphyromonas gingivalis. J Antimicrob Chemother 2006; 58:439-43.
- Franca JR, et al. Propolis -based chitosan varnish: drug delivery, controlled release, and antimicrobial activity against oral pathogen bacteria. BMC Complement Altern Med 2014; article 478.
- Srinivas M, et al. A study to assess and compare the peripheral blood neutrophil chemotaxis in smokers and non-smokers with healthy periodontium, gingivitis, and chronic periodontitis. J Indian Soc Periodontol 2012; 16:54-8.
- Larsen T, Fiehn NE. Dental biofilm infections–an update. Apmis 2017; 125:376-84.
- Manji F, et al. Caries and periodontitis: contesting the conventional wisdom on their aetiology. Caries Res 2018; 52:548-64.
- Wang JC, et al. Planktonic growth of Pseudomonas aeruginosa around a dual-species biofilm supports the growth of Fusobacterium nucleatum within that biofilm. Int J Otolaryngol 2017; 2017:3037191.
- Kalia P, et al. Peptide-modified nanoparticles inhibit formation of Porphyromonas gingivalis biofilms with Streptococcus gordonii. Int J Nanomedicine 2017; 12:4553-62.
- He J, et al. The oral microbiome diversity and its relation to human diseases. Folia Microbiol 2015; 60:69-80.
- Eke PI, et al. Periodontitis prevalence in adults 65 years of age, in the USA. Periodontology 2016; 72:76-95.
- Könönen E, et al. Bacteroides, Porphyromonas, Prevotella, Fusobacterium, and other anaerobic Gram-negative rods. In: Manual of clinical microbiology, Eleventh Edition. American Society of Microbiology, 2015; 967-93.
- Barros SP, et al. Gingival crevicular fluid as a source of biomarkers for periodontitis. Periodontology 2016;70:53-64.
- Beall CJ, et al. Genomics of the uncultivated, periodontitis-associated bacterium Tannerella sp. BU045 (Oral taxon 808). mSystems 2018; 3:e00018-e00018
- Kumar PS. Diversity of oral biofilms in periodontal health and disease. In: Pathogenesis of Periodontal Diseases. Springer, 2018; 9-20.
- Madianos PN, et al. Adverse pregnancy outcomes (APOs) and periodontal disease: pathogenic mechanisms. J Clin Periodontol 2013; 40:S170–S180.
- Hajishengallis G. Periodontitis: from microbial immune subversion to systemic inflammation. Nat Rev Immunol 2015; 15:30-44.
- Mombelli A. Antimicrobial advances in treating periodontal diseases. In: Periodontal Disease, vol 15. Karger publishers, 2012; 133-48.
- Hajishengallis G, Lamont RJ. Beyond the red complex and into more complexity: the polymicrobial synergy and dysbiosis (PSD) model of periodontal disease etiology. Mol Oral Microbiol 2012; 27:409-19.