INTRODUZIONE
Il giorno 11 marzo 2020 il direttore generale dell’OMS Tedros Adhanom Ghebreyesus ha definito la diffusione del COVID-19 non più una epidemia confinata ad alcune zone geografiche, ma una pandemia diffusa in tutto il mondo (1). SARS-CoV-2 non era mai stato identificato prima di essere segnalato nel mese di Dicembre 2019 a Wuhan (2). Un gruppo di esperti appositamente incaricati di studiare il nuovo ceppo di coronavirus, lo ha definito “Sindrome respiratoria acuta grave Coronavirus 2” (SARS-CoV-2), in quanto appartiene alla stessa famiglia di virus della Sindrome Respiratoria Acuta Grave (SARS). La comparsa di nuovi virus patogeni per l’uomo, precedentemente circolanti solo nel mondo animale, è un fenomeno ampiamente conosciuto, chiamato spill-over o salto di specie, e si pensa che possa essere alla base anche dell’origine del nuovo coronavirus (3).
L’odontoiatria italiana non ha mai cessato la propria attività, limitandola però nella fase uno alla gestione delle urgenze e di quelle prestazioni giudicate indifferibili dal sanitario e dal paziente.
Il Tavolo tecnico di odontoiatria insediatosi ad aprile 2020, presieduto dal professor Enrico Gherlone, Rettore dell’Università Vita Salute San Raffaele e primario dell’unità odontoiatrica dell’ospedale stesso, ha emanato il documento ufficiale dal titolo “Indicazioni operative per l’attività odontoiatrica durante la fase 2 della pandemia COVID-19” approvato dal Tavolo Scientifico Centrale del Ministero della Salute (4). Alla luce, infatti, dell’evidente rischio a cui è esposto l’ambiente odontoiatrico, tra cui gli operatori in primis, sono stati riconosciuti diversi livelli di protezione per permettere a questi ultimi di lavorare in sicurezza per sé stessi e per i pazienti non andando a modificare le procedure sia in ambito odontoiatrico che durante le manovre di igiene orale professionale (5). Le procedure odontoiatriche comportano il rischio di infezione da SARS-CoV-2 a causa della specificità delle procedure stesse, si parla infatti di trasmissione diretta per quanto riguarda la distanza tra operatore e paziente, l’esposizione a saliva, sangue e altri fluidi corporei (6), l’utilizzo di strumenti appuntiti e di strumenti rotanti generanti droplets (7), il contatto con la mucosa gengivale (8), e infine il contatto con goccioline prodotte da tosse e secrezione nasale di un individuo infetto senza mascherina a breve distanza, che aumenta significativamente il rischio biologico per l’operatore (9,10).
L’igienista dentale riveste un ruolo fondamentale nella gestione dell’emergenza sociosanitaria attualmente ancora in atto, attraverso la sensibilizzazione e l’informazione dei pazienti, i quali con l’instaurarsi di corrette abitudini per il mantenimento sia domiciliare che professionale delle riabilitazioni implantari, partecipano attivamente alla prevenzione dello sviluppo delle patologie legate al cavo orale, anche quelle da SARS- CoV-2. In collaborazione con l’odontoiatra, l’igienista dentale deve operare tramite un protocollo operativo funzionale al fine di perseguire come obiettivo principale, di fronte a riabilitazioni di tipo implantosupportate, quello di garantirne il successo a lungo termine lavorando in sicurezza.
I criteri per il successo dell’impianto sono stati ampiamente descritti da Albrektsson nel 1993 (11) e sono:
- assenza di mobilità;
- assenza di disturbi soggettivi persistenti (dolore, sensazione di corpo estraneo, disestesia);
- assenza di radiotrasparenza;
- nessun sanguinamento al sondaggio;
- dopo il primo anno di carico, perdita ossea verticale superiore a 0,2 mm.
L’igienista dentale ha quindi il ruolo di controllare e monitorare questi parametri e i fattori di rischio correlati al paziente, i quali possono contribuire da soli o in associazione con lo sviluppo di patologie perimplantari e sulla base di questi ultimi stabilire uno schema operativo che preveda sedute di igiene orale professionale di mantenimento con un follow-up scandito proprio dal rischio al quale il paziente è esposto (12).
La periodica ed efficacie rimozione professionale del biofilm sopra e sottogengivale risulta fondamentale nel mantenere le condizioni di salute parodontale e perimplantare, evitando che si creino le condizioni favorevoli per l’adesione dei patogeni. È importante impiegare strumenti espressamente dedicati alla profilassi dell’implantoprotesi e del sito implantare adatti sia al follow-up condotto su impianti sani, sia per il trattamento della patologia perimplantare e accomunati dall’efficacia nel rimuovere placca batterica e tartaro dalle superfici in titanio e contemporaneamente non danneggiarle nè alterarne le superfici (13).
L’obiettivo di questo protocollo clinico vuole essere quello di analizzare la letteratura per proporre una procedura efficacie nella rimozione del biofilm dalle superfici implantari e non invasiva, conservando l’integrità delle superfici implantari, rispettosa delle indicazioni ministeriali per la pratica clinica odontoiatrica durante la pandemia COVID-19.
MATERIALI E METODI
È stata effettuata una ricerca bibliografica tramite i data base di Pubmed e Cochrane Library. Sono state inserite le parole chiave: “air abrasive decontamination”, “mechanical instrumentation”/ “manual instrumentation”. Alla fine abbiamo ottenuto come risultato 36 articoli.
RISULTATI
Sono stati inclusi nel presente studio 29 articoli dei 36 ottenuti dai quali è stato elaborato il protocollo clinico. Ne sono stati scartati 7 per la mancanza del testo completo.
Protocollo operativo per sedute di igiene orale professionale in pazienti con riabilitazione implantare
Abbiamo creato un protocollo clinico valido sia per l’igienista dentale che per l’odontoiatra, nel trattamento delle superfici implantari che risulti mininvasivo e che permetta all’operatore di lavorare in sicurezza. Questo di basa su un approccio già affermato ed efficacie definito gold standard nel mondo dell’igiene orale professionale ed in definitiva prevede l’utilizzo dei moderni sistemi di airpolishing e periopolishing, con l’incremento dei DPI (Dispositivi di Protezione Individuali) e di tutte le procedure necessarie atte a ridurre la produzione di aerosol e splatter.
Il primo passaggio fondamentale è saper classificare il paziente come caso sospetto, probabile o confermato attraverso le procedure di triage, una prima valutazione compresa una sintesi della storia di viaggi, clinica, epidemiologica e della presentazione clinica del paziente stesso per valutare la probabilità di una infezione da SARS-CoV-2 (14).
All’arrivo nello studio il paziente viene accolto da personale dotato di mascherina chirurgica e invitato a depositare tutti i suoi effetti personali in una sacca prima di entrare nella sala operativa (15). Viene invitato a lavarsi le mani o alla disinfezione di queste con soluzione idroalcolica in gel o liquida (16).
Quindi il paziente compilerà il questionario COVID, il quale permette di intraprendere un adeguato percorso di informazione e consenso al paziente ove lo si rende edotto in merito ai protocolli utilizzati in modo specifico per la pandemia (17). È importante che il paziente indossi la mascherina chirurgica durante tutte le procedure di triage fino all’inizio della fase operativa. Durante le procedure, oltre alla mantellina idrorepellente è indicato far indossare al paziente la cuffia in TNT, i calzari monouso e gli occhiali protettivi.
Il secondo passaggio prevede poi la preparazione e la protezione delle attrezzature di lavoro e degli ambienti lavorativi compreso il campo operatorio, lasciando meno oggetti possibili sulle superfici, ricoprendo con polietilene le tastiere dei computer al fine di consentirne la detersione.
Prima che il paziente entri, predisporre tutto il necessario per la seduta lasciando coperti gli strumenti, compresa la documentazione (18). Gli operatori che si occuperanno della seduta di igiene orale professionale saranno adeguatamente protetti con i seguenti DPI.
- Camice idrorepellente monouso in TNT o riutilizzabili dopo la sterilizzazione in TTR (5).
- Cuffia monouso in TNT (19).
- Respiratore facciale FFP2 (16).
- Mascherina chirurgica.
- Occhiali protettivi (15).
- Schermo facciale (19).
- Guanti: meglio se applicato un disinfettante sugli stessi.
Prima di iniziare le procedure odontoiatriche far eseguire due sciacqui al paziente.
- Un primo sciacquo con una soluzione all’1% di perossido di Idrogeno (una parte di acqua ossigenata a 10 volumi/3% e due parti di acqua) o con Iodo-povidone 0,2% effettuando gargarismi per 30 secondi o con cetilpiridinio cloruro allo 0,05-0,1% per un minuto (15).
- Un successivo sciacquo con collutorio alla clorexidina 0,2-0,3% per 1 minuto: la clorexidina rispetto agli altri disinfettanti ha un’azione battericida minore, ma è in grado di ridurre la carica batterica nell’aerosol (20).
Risulta fondamentale in primis eseguire l’indagine anamnestica del paziente in modo da poter escludere eventuali controindicazioni all’utilizzo di determinati strumenti. In seguito, attraverso un accurato esame intraorale, sarà possibile identificare la tecnica di rimozione del biofilm più adeguata al singolo caso. In questo momento si andranno a rilevare i parametri che consentono di identificare lo stato di salute, indice di placca (IP), sanguinamento al sondaggio (BOP), presenza di suppurazione (SUPP), profondità di sondaggio (PPD) e mobilità. Varie analisi cliniche odontoiatriche hanno permesso di concludere che a oggi il trattamento professionale degli elementi implantari deve prevedere in prima fase la motivazione all’igiene orale. Questa fase è fondamentale poiché permette di far conoscere il cavo orale e il tipo di riabilitazione al paziente per sensibilizzarlo a una corretta prevenzione e cura (21).
Dalla revisione della letteratura sulle metodiche più accreditate a oggi esistenti per una corretta profilassi igienica di mantenimento degli impianti è emerso che gli strumenti metallici causano cambiamenti a livello della superficie dell’impianto, mentre scaler o curette in plastica, titanio, resina rinforzata o polietere etere chetone (PEEK) risultano strumenti efficaci per la rimozione del biofilm batterico e del tartaro dalle superfici implantari lisce, ma non da quelle ruvide (22). Le polveri di glicina ed eritritolo invece, sono efficaci nella rimozione del biofilm, da tutte le superfici implantari e in termini di conservazione dell’integrità della superficie non causano alcun cambiamento (23). Gli ultrasuoni con la punta metallica e in materiale plastico se da una parte sono efficaci nella rimozione della placca batterica, dall’altra sono tra gli strumenti meccanici che creano più danni superficiali, formando delle nicchie ritentive che aumentano la colonizzazione batterica della superficie dell’impianto (24).
Le polveri di glicina hanno una granulometria inferiore ai 63 µm, pertanto viene utilizzata durante i trattamenti di igiene orale tramite dispositivi di air- e perio- polishing per rimuovere il biofilm batterico, le discromie estrinseche e per la detossificazione delle tasche parodontali fino a 5 mm (25).
La polvere a base di eritritolo con una granulometria di 14 µm si classifica come la particella più fine nel mondo dell’odontoiatria. Il vantaggio di questo tipo di polvere è che permette un getto minimamente abrasivo e selettivo: è in grado di rimuovere efficacemente il biofilm senza alcun danno su tessuti molli o duri sia di elementi naturali sia di manufatti protesici.
I moderni apparecchi di lucidatura ad aria e acqua insieme a specifiche polveri per l’applicazione sia sopra che sottogengivale, si sono affermati come metodi efficaci e hanno assunto un ruolo sempre più importante nella terapia di mantenimento (24).
L’airpolishing è un’opzione sicura, rapida e più ergonomica rispetto agli ultrasuoni o alla strumentazione manuale (26). In particolare le polveri di glicina grazie al loro elevato potere antimicrobico e alla loro granulometria ridottissima, permettono un’accurata disinfezione sopra e sotto gengivale dell’intero cavo orale, soprattutto a livello del tragitto transmucoso dell’abutment. La rimozione totale del biofilm batterico a livello sopra e sottogengivale permette una disinfezione profonda a livello tissutale. Questo risulta importante per evitare l’insorgere ed il persistere di condizioni infiammatorie a livello dei tessuti gengivali (27).
Prima di procedere è raccomandabile la protezione degli occhi del paziente, previa rimozione degli eventuali occhiali da vista. Lo stesso vale per le labbra e le guance, attraverso l’utilizzo del divaricatore, che conferisce comfort al paziente, miglior accesso al campo di trattamento e una riduzione della dispersione dell’areosol prodotto (23).
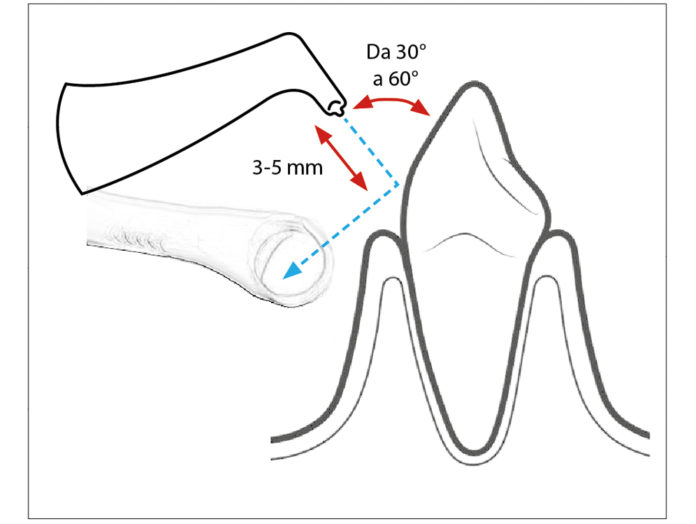
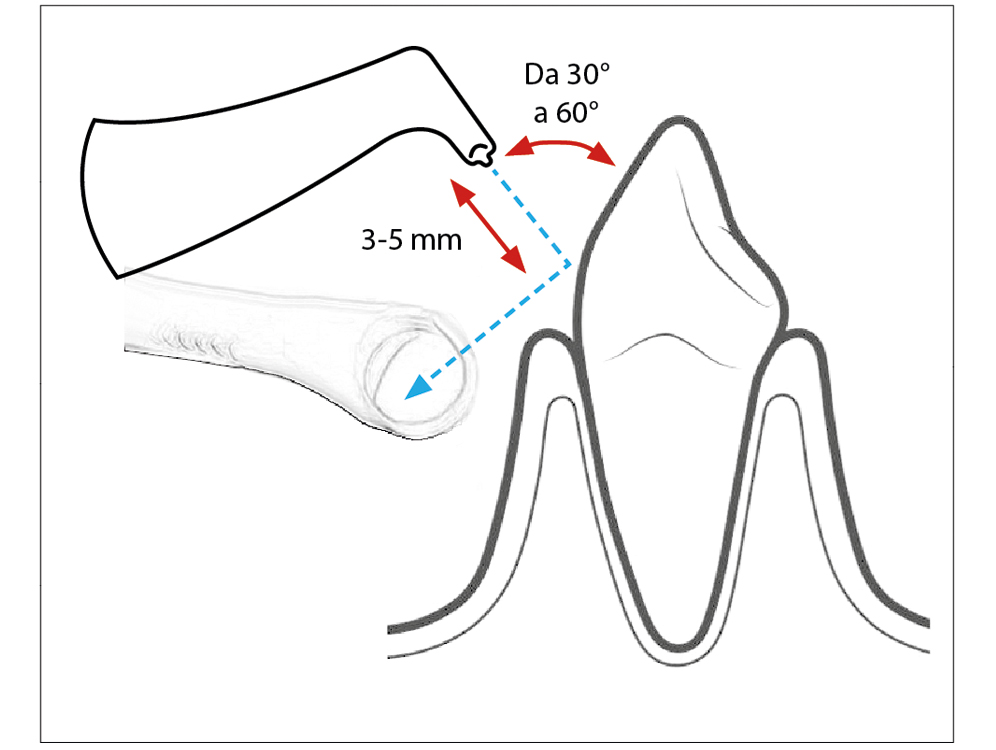
Nella tecnica sopragengivale l’ugello dello strumento deve essere mantenuto a una distanza di 3-5 mm dalla superficie dell’elemento protesico, eseguendo un movimento continuo per circa 5 secondi per ogni elemento (28). Per una terapia di mantenimento occorre lavorare con un angolo di inclinazione compreso tra 30° e 60°, prestando attenzione a non direzionare il manipolo perpendicolarmente alla superficie dell’elemento, evitando anche le aperture dei condotti salivari, in quanto potrebbe provocare dolore e arrossamento temporanei (29). È importante inoltre, dirigere il getto verso la cannula d’aspirazione ad alta velocità. La corretta angolazione del manipolo è essenziale per evitare traumi ai tessuti molli e per ridurre la quantità di aerosol che viene emessa (30) (Fig. 1).
Se la mucosa è più profonda di 4 mm, occorrerà utilizzare la tecnica di periopolishing, in quanto per la rimozione efficacie del biofilm in presenza di una tasca a livello implantare è indicato l’utilizzo dell’eritritolo. L’applicazione sottogengivale della polvere di eritritolo mediante l’airpolishing, può essere considerata sicura e viene eseguita in presenza di tasche parodontali comprese tra i 4 e i 9 mm. Questa manovra risulta essere molto ben accetta dal paziente rispetto al trattamento con strumenti manuali, e totalmente indolore (31).
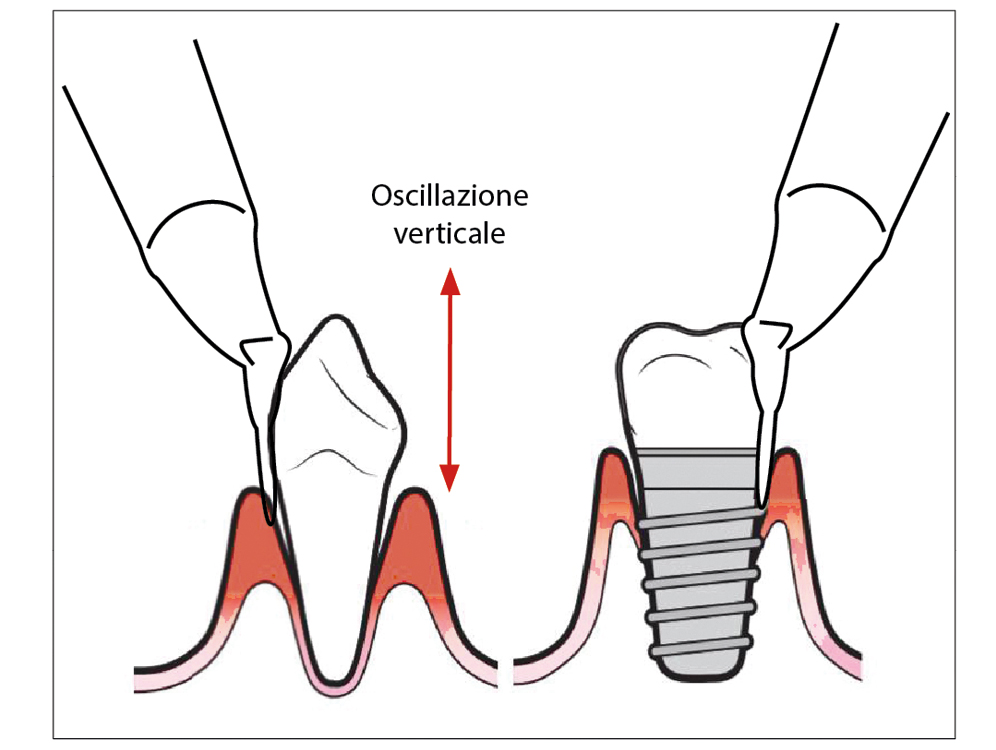
È necessario inserire senza sforzo l’ugello dotato di puntale specifico perioflow nella tasca. Questo va utilizzato fino a un massimo di 5 secondi con oscillazioni verticali continue lungo la tasca (Fig. 2).
Durante i trattamenti di air e periopolishing è noto che l’erogazione delle polveri tramite gli apparecchi utilizzati produce un getto abbondante di acqua e polvere che contiene microrganismi e residui orali; quindi come per tutti gli aerosol è possibile che vi sia pericolo di contaminazione. Al fine di ridurre al minimo questo rischio, uno studio condotto al Baylor College of Dentistry nel 2004 da Harrel e Molinari ha dimostrato l’importanza dell’utilizzo dell’aspiratore ad alta velocità, munito di ampio beccuccio e posizionato in direzione opposta al getto, il più vicino possibile all’ugello, in quanto l’aspirasaliva risulta insufficiente a ridurre il numero di batteri dell’aerosol (32).
Al termine della prestazione, dopo aver congedato il paziente è di fondamentale importanza eseguire correttamente e scrupolosamente tutte le fasi di riordino e di disinfezione; in aggiunta ventilare l’ambiente per almeno 15 minuti.
DISCUSSIONE
A oggi di fronte all’emergenza socio-sanitaria COVID-19, visto l’evidente rischio al quale l’ambiente odontoiatrico è esposto, secondo le indicazioni operative, l’obiettivo principale durante le procedure di igiene orale professionale risulta quello di ridurre al minimo la produzione di aerosol e splatter.
Per aerosol si intende una sospensione colloidale di particelle liquide o solide in un gas. È necessario quindi, capire la distinzione tra i diversi tipi di aerosol che vengono prodotti utilizzando i sistemi di airflow, per poterne comprendere i relativi rischi che non vanno confusi, in quanto controllabili e riducibili (33).
Il sistema funziona tramite aria compressa che passa attraverso la camera della polvere, viene riempita e si crea così una miscela di polvere e aria, un aerosol di pulviscolo. La contaminazione avviene quando la polvere arriva sulla superficie dentale. All’interno del sistema, per evitare che questo aerosol di pulviscolo si diffonda nell’aria, viene aggiunta dell’acqua, che a sua volta genera droplets, un aerosol liquido che circonda l’aerosol della polvere e ne impedisce la diffusione (34).
Vi sono quattro tipi di prodotti:
- particelle solide;
- aerosol del dispositivo;
- splatter;
- aerosol del trattamento.
1 Particelle solide
Diversi studi hanno dimostrato che le particelle solide sono sicure perché raggiungono la superficie dentale ad una velocità di 700 km all’ora e colpiscono i batteri. Grazie a questa elevata velocità ed energia d’impatto prodotta, è quasi impossibile per i batteri rimanere intrappolati all’interno delle particelle (37).
2 Aerosol del dispositivo
L’aerosol del dispositivo risulta essere anch’esso sicuro, in quanto generato con acqua distillata appositamente controllata e filtrata.
3 Splatter
Lo splatter è costituito da goccioline di dimensioni abbastanza grandi, tra 50 e 500 µm, che fuoriescono dal cavo orale e, senza un adeguato sistema di aspirazione, si diffondono sui dispositivi di protezione dell’operatore e del paziente. La contaminazione dello splatter è solo locale, rimane intorno alla zona di trattamento. È quindi fondamentale avere una buona protezione individuale oltre che garantire la riduzione della carica batterica della cavità orale (35).
4 Aerosol del trattamento
L’aerosol di principale interesse per i professionisti del settore odontoiatrico è quello prodotto dal trattamento, il cui grado di contaminazione è definito contando il quantitativo di batteri contenuti nella saliva in esso presente (36). Il trattamento, se eseguito correttamente, prevede l’applicazione dell’apribocca, lo sciacquo preoperatorio di 60 secondi con antibatterico, l’udo dell’aspirasaliva tradizionale associato a una corretta aspirazione ad alta velocità per aspirare il getto sin dalla base. I risultati mostrano che la quantità di batteri presenti in 1 litro d’aria raccolta durante il trattamento corretto, rispetto ai batteri presenti nella stessa quantità d’aria di un ambiente dove vi è una normale contaminazione aerea, è la stessa (37). Perciò il trattamento se eseguito correttamente non produce contaminazione rilevabile. Inoltre, eseguendo il trattamento correttamente, si è in grado di contenere nell’aria la dispersione di aerosol contenente sia polvere sia saliva (che come sappiamo è uno dei principali mezzi di veicolazione del virus), riducendo in questo modo la contaminazione (38).
CONCLUSIONE
La ricerca eseguita, mette in luce le peculiarità di una tecnica già ampiamente affermata nel mondo dell’igiene orale professionale, che prevede l’utilizzo dei sistemi di airpolishing e periopolishing, sulla base della quale abbiamo creato un protocollo clinico professionale. Questa tecnica, non solo risulta efficace in termini di rimozione dei biofilm batterico, delle pigmentazioni estrinseche e di decontaminazione delle tasche perimplantari, ma si è dimostrata essere in definitiva l’opzione più conservativa nei confronti dell’integrità della superficie implantare.
L’obiettivo del protocollo è quello di evidenziare come l’utilizzo di questa specifica strumentazione possa essere resa sicura in termini di rischio di diffusione del virus SARS-CoV-2. A questo proposito, è stato dimostrato da diversi studi, tra i più rilevanti quelli di Harrel et al. (32) e Narayana et al. (39), che se utilizzati correttamente in combinazione, l’aspirazione ad alta velocità eventualmente integrata con l’utilizzo di cappe operatorie, l’associazione di due sciacqui preoperatori, il primo a base di perossido di idrogeno e il secondo con collutorio contenente clorexidina e l’utilizzo dei DPI sia da parte dell’operatore che del paziente, è possibile ridurre più del 99% la contaminazione aerea. Senza dimenticare che grazie al doppio triage, si è in grado di intercettare scrupolosamente i pazienti che presentano sintomatologia dubbia prima dell’accesso allo studio odontoiatrico.
In conclusione, l’accettazione e la propensione al cambiamento sono due attitudini essenziali che l’igienista dentale deve sempre avere, quindi è fondamentale continuare a lavorare per la salute dei nostri pazienti con protocolli di sicurezza adeguati e aggiornati, per l’operatore e per i pazienti stessi.
- WHO, Director-General’s operning remarks at the media briefing on COVID-19. 11 March 2020
- Chan JF-W, Yuan S, Kok K-H, To KK-W, Chu H, Yang J, et al. A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating personto-person transmission: a study of a family cluster. Lancet 2020;395:14-23.
- Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 2020;395:497-506.
- Ministero della Salute, Raccomandazioni cliniche per l’attività odontoiatrica durante la Fase 2 della pandemia Covid-19. 30 Maggio 2020.
- Peng X, Xu X, Li Y, Cheng L, Zhou X, Ren B. Transmission routes of 2019-nCoV and controls in dental practice. Int J Oral Sci 2020 Mar 3;12(1):9.
- Belser JA, Rota PA, Tumpey TM. Ocular tropism of respiratory viruses. Microbiol Mol Biol Rev 2013 Mar;77(1):144-56.
- Lu CW, Liu XF, Jia ZF. 2019-nCoV transmission through the ocular surface must not be ignored. Lancet. 2020 Feb 22;395(10224):e39.
- Rothe C, Schunk M, Sothmann P et al. Transmission of 2019-nCoV Infection from an Asymptomatic Contact in Germany. N Engl J Med 2020 Mar 5;382(10):970-971.
- Cleveland JL et al. Transmission of blood- borne pathogens in US dental health care settings: 2016 update. J Am Dent Assoc 2016;147:729–738.
- Liu L et al. Epithelial cells lining salivary gland ducts are early target cells of severe acute respiratory syndrome coronavirus infection in the upper respiratory tracts of rhesus macaques. J Virol 2011;85:4025–4030.
- Albrektsson T, Zarb Ga. Current interpretations of the osseointegrated response: Clinical significance. Int J Prosthodont 1993; 6(2):95-105.
- Polizzi E, Tetè G. Nuovo protocollo di mantenimento nei pazienti con riabilitazione implantare. Rivista Italiana Igiene Dentale 2019; 15(2): 83-90.
- Hempton TJ, Boonacci FJ, Lancaster D, et al. Implant maintenance. Dimens Dent Hyg 2011:9(1):58–61.
- Ather A, Patel B, Ruparel NB, Diogenes A, Hargreaves KM. Coronavirus Disease 19 (COVID-19): Implications for Clinical Dental Care. J Endod 2020 Apr 6.
- Meng L, Hua F, Bian Z. Coronavirus Disease 2019 (COVID-19): Emerging and Future Challenges for Dental and Oral Medicine. First Published March 12, J Dent Res 2020 Mar: [Epub ahead of print];
- WHO, Rational use of personal protective equipment for coronavirus disease 2019 (Covid-19) and considerations during severe shortages Interim Guidance 6 April (2020).
- Coulthard P. Urgent dental care for patients during COVID-19 pandemic. The Lancet PublishedOnline April 3, 2020.
- Otter JA et al. Transmission of SARS and MERS coronaviruses and influenza virus in healthcare settings: the possible role of dry surface contamination. J Hosp Infect 2016;92:235–250.
- Yang Y, Soh HY, Cai ZG, Peng X, Zhang Y, Guo CB. Experience of Diagnosing and Managing Patients in Oral Maxillofacial Surgery during the Prevention and Control Period of the New Coronavirus Pneumonia Chin J Dent Res 2020;23(1):57–62.
- Kariwa H, Fujii N, Takashima I. Inactivation of SARS coronavirus by means of povidoneiodine, physical conditions and chemical reagents. J Dermatology 2006;212 Suppl 1:119-123.
- Wilkins EM. La pratica clinica dell’igienista dentale. III edizione italiana a cura di G.M. Nardi 2020.
- Moharrami M, Perrotti V, Iaculli F, Love RM, Quaranta A. Effects of air abrasive decontamination on titanium surfaces: A systematic review of in vitro studies. Clin Implant Dent Relat Res 2019;21:398–421.
- Wennstrom JL, Dahlen G, Ramberg P. Subgingival debridment of periodontal pockets by air polishing in comparison with ultrasonic instrumentation during maintenance therapy. J Clin Periodontol 2011; 38: 820–827.
- Matsubara VH, Leong BW, Leong MJL, Lawrence Z, Becker T, Quaranta A. Cleaning potential of different air abrasive powders and their impact on implant surface roughness. Clin Implant Dent Relat Res 2020; 22:96–104.
- Petersilka GJ. Subgingival air- polishing in the treatment of periodontal biofilm infections. Periodontology 2000 2011; 55: 124-142.
- L. Nastri, G. Miraldi R. Ripoli. Treatment of peri-implantitis using an air polishing device with erythritol powder or mechanical debridement: a randomized, controlled split mouth clinical study. Seconda Università degli Studi di Napoli, Naples, Italy Studio miraldi, Naples, Italy, Clin Oral Impl Res 25 (suppl 10 ), 2014
- Schwarz F, Becker K, Renvert S. Efficacy of air polishing for the non‐surgical treatment of peri‐implant diseases: a systematic review. J Clin Periodontol 2015 Oct;42(10):951-9.
- Barnes CM, Covey D, Watanabe H, et al. An in vitro comparison of the effects of various air polishing powders on enamel and selected esthetic restorative materials. J Clinical Dent 2014;25:76-87.
- Di Salle A, Spagnuolo G, Conte R, Procino A, Peluso G, Rengo C. Effects of various prophylactic procedures on titanium surfaces and biofilm formation. J Periodontal Implant Sci 2018 Dec 27;48(6):373-382.
- Bühler J, Amato M, Weiger R, Walter C. A systematic review on the effects of air polishing devices on oral tissues. Int J Dent Hyg 2016 Feb;14(1):15-28.
- Moëne R, Décaillet F, Andersen E, Mombelli A.Subgingival Plaque removal using a new air‐ polishing device. J Periodontol 2010 Jan;81(1):79-88.
- Harrel SK, Molinari J. Aerosols and splatter in dentistry: a brief review of the literature and infection control implications. J Am Dent Assoc 2004 April; 135:429-37.
- Bennet AM, F. M. Microbial aerosols in general dental. British Dental Journal 2000; 189(12):664-667.
- Watanabe A, T.N. Use of ATP bioluminescence to survey the spread of aerosol and splatter during dental tretaments. J Hazard Mater 2019;369(5):684-690.
- Gupta G, Mitra D, Ashok KP, Gupta A, Soni S, Ahmed S, Arya A (2004) Efficacy of preprocedural mouth rinsing in reducing aerosol contamination produced by ultrasonic scaler: a pilot study. J Periodontol 2014;85(4):562-8.
- Mensi M., Donnet M. Aerosol nella terapia non chirurgica: un rischio per i professionisti del settore dentale. 23 Luglio 2020
- Lussi A, Bastendorf K-D, Mensi M, Donnet M. La contaminazione batterica dell’aria nella sala operativa durante un trattamento airflow. Dental Tribune Italian Edition 2020; 10:20.
- Pyankov OV, Bodnev SA, Pyankova OG, Agranovski IE. Survival of aerosolized coronavirus in the ambient air. J Aerosol Sci 2018; 115: 158-163.
- Narayana TV, Mohanty L, Sreenath G, Vidhyadhari P. Role of preprocedural rinse and high volume evacuator in reducing bacterial contamination in bioaerosols. J Oral Maxillofac Pathol 2016 ;20(1):59-65.