INTRODUZIONE
La malattia parodontale è la malattia infiammatoria non trasmissibile (Non Communicable Cronic Desease) più diffusa e costituisce un vero e proprio problema di salute pubblica: il suo impatto non coinvolge solamente la perdita della funzione masticatoria, ma si traduce anche nella riduzione della qualità della vita e della salute generale degli individui che ne sono affetti. Colpisce circa il 50% della popolazione nelle forme di stadio I e II, mentre nell’11% dei soggetti si presenta nelle forme più gravi (stadio III e IV), traducendosi in elevati costi pubblici: basti pensare che nel 2015 la cura della parodontite ha portato a un esborso di 545 miliardi di dollari a livello mondiale (1).
I meccanismi che collegano negativamente l’infezione-infiammazione parodontale all’organismo sono duplici; da un lato i batteri parodontopatogeni possono migrare verso distretti anche lontani dal cavo orale tramite il flusso ematico ed esprimere a distanza i loro fattori di virulenza; dall’altro lato l’alterata risposta immunitaria che caratterizza la parodontite sottopone il corpo a un continuo stress, mediato dalla diversificata e individuale produzione di citochine note (2). A tal proposito è possibile trovare un ampio consenso in letteratura circa i numerosi legami tra parodontite e alterate condizioni sistemiche dell’organismo, come le malattie metaboliche, quelle cardiovascolari e l’artrite reumatoide (3,4,5,6). Una delle correlazioni maggiormente validate riguarda proprio la malattia parodontale e il diabete, tanto da delineare che tra le due patologie ci sia un legame di tipo bidirezionale: i soggetti affetti da parodontite sembrano mostrare un peggior controllo metabolico, così come i soggetti con prediabete o diabete non controllato manifestano un peggioramento della situazione parodontale, tanto che la parodontite è stata annoverata come la sesta complicanza del diabete di tipo 2 (3).
L’elevata prevalenza della parodontite sommata al fatto che lo studio odontoiatrico sia annoverabile tra le strutture medico professionali routinariamente frequentate dalla popolazione, fanno individuare il setting odontoiatrico come cruciale per indirizzare il paziente verso una diagnosi precoce di prediabete o diabete di tipo 2. Sappiamo, infatti, che la vera e propria diagnosi di malattia diabetica molto spesso avviene quando le complicanze della malattia sono già in atto (7,8).
Questo articolo si pone l’obiettivo di descrivere il protocollo messo in atto nella nostra struttura libero professionale per la diagnosi precoce di diabete e prediabete, inserito nel work flow del trattamento della parodontite del quale anche l’igienista dentale è protagonista all’interno di un team strutturato e dinamico, che ha quindi l’obiettivo di curare la parodontite unitamente a quello di interpretare il ruolo di sentinelle del buono stato di salute generale dell’individuo.
IL DIABETE
Per diabete mellito si intende un gruppo di alterazioni del metabolismo con diverse eziologie che conducono a uno stato di iperglicemia cronica a causa della mancata azione dell’ormone insulina. In Italia ne sono affette circa 5.200.000 soggetti: circa 300 mila soffrono di DT1, mentre a legno il 4,9% convive con il DT2 (dati 2018-2019); a questa patologia, che rappresenta l’ottava causa di morte al mondo, sono associate gravi comorbilità.
Il diabete di tipo 1 (in passato definito “diabete giovanile”) si caratterizza per l’assenza totale o parziale di secrezione dell’insulina, causata dalla distruzione per cause autoimmuni delle cellule beta nelle isole di Lagerhans nel pancreas; si manifesta prevalentemente in età giovanile e conduce a sequele molto gravi come il coma chetoacidosico oltre a sintomi come polinuria, perdita di peso, forte senso di sete. Per i pazienti affetti da DT1 la somministrazione di insulina è necessaria per la sopravvivenza (9). Nel diabete di tipo 2 (DMT2) l’eziologia è prevalentemente legata agli stili di vita (alimentazione, scarsa attività fisica e fumo), sebbene anche fattori genetici possano giocare un ruolo peggiorativo; si assiste a una ridotta produzione dell’insulina associata a insulino-resistenza: nella fattispecie, il glucosio non riesce a essere stoccato e quindi utilizzato dai vari organi a causa della riduzione dei recettori per l’insulina, rimanendo elevato nel flusso sanguigno con conseguente iperglicemia. A differenza del diabete di tipo 1, nel diabete di tipo 2 la manifestazione della malattia risulta essere molto più lenta: frequentemente la diagnosi avviene in maniera casuale. Proprio a causa della natura subdola del DMT2, si stima che in Italia ci siano circa un milione e mezzo di casi non ancora diagnosticati. Le complicanze del DMT2 sono legate essenzialmente al danno micro e macrovascolare e dallo stress ossidativo causati dall’iperglicemia; tali situazioni coinvolgono l’apparato cardiocircolatorio (angina, infarto, vasculopatia periferica), l’occhio (retinopatia), il rene (insufficienza renale) e il sistema nervoso. La terapia del DT2 contempla la somministrazione di insulina, ma più spesso il trattamento farmacologico mira a controllare i meccanismi dell’insulino-resistenza (metformina, le gliptine, analoghi del GLP-1, inibitori dei trasportatori renali di glucosio SGLT-2); oltre alle terapie farmacologiche il controllo dello stile di vita, soprattutto per quanto concerne l’alimentazione, rappresenta il pilastro nel controllo della patologia (10).
LA PARODONTITE E LA SUA CLASSIFICAZIONE
La malattia parodontale è caratterizzata dalla progressiva distruzione dei tessuti di sostegno del dente e trova la sua eziologia nei batteri parodontopatogeni contenuti nel biofilm orale (11); quest’ultimo se non correttamente rimosso con le manovre di igiene orale domiciliare e professionale, provoca nelle prime fasi di accumulo una gengivite, uno stato infiammatorio reversibile a carico della gengiva marginale. Tuttavia, In alcuni soggetti suscettibili, questa infiammazione può evolvere in parodontite franca, con caratteristiche di cronicità e progressività.
I soggetti che sviluppano la malattia parodontale possiedono, infatti, un profilo iperinfiammatorio che può essere innato o acquisito; la suscettibilità innata è rappresentata da un’alterazione genetica della risposta a livello delle citochine infiammatorie; quella acquisita, invece, è legata agli stili di vita (come il fumo e lo stress) o ad alcune patologie (come le alterazioni metaboliche e l’obesità) (12,13,14).
La parodontite nelle sue fasi iniziali è pressoché asintomatica e i suoi primi segnali, come il sanguinamento gengivale, sono spesso sottovalutati dal paziente, pertanto, è importante intercettare la malattia sin dalle sue prime manifestazioni, onde evitare una grave ed estesa distruzione del supporto parodontale.
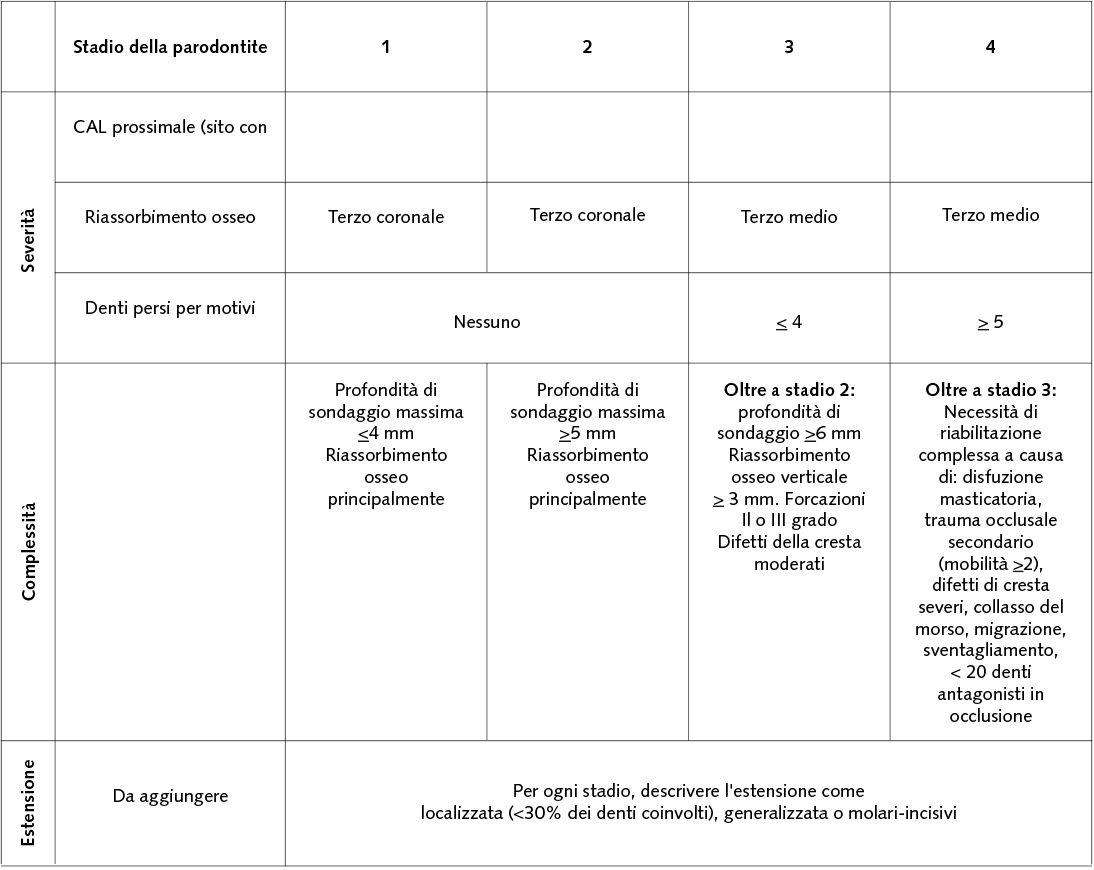
La diagnosi clinica viene effettuata primariamente con il sondaggio tramite sonda parodontale, che misura la perdita di attacco alveolo-dentale; possibilmente viene anche effettuato un esame radiografico endorale volto a valutare il riassorbimento osseo: proprio sul livello di perdita di attacco radiografico interprossimale si basa la nuova classificazione delle parodontiti (15). Questa nuova classificazione prevede che la parodontite sia classificata secondo lo stadio (da 1 a 4) e il grado (da A a C): lo stadio rappresenta la gravità della malattia al momento della diagnosi e la relativa complessità del suo trattamento; lo stadio descrive il rischio di progressione e la capacità di rispondere alle terapia in base alle caratteristiche biologiche della patologia (Tab. 1, 2).
Il trattamento della malattia parodontale, soprattutto negli stadi incipienti (stadio 1 e 2), è efficace e consente di preservare gli elementi dentari.
La prima fase della terapia è non chirugica, ma causale, e mira a eliminare tutti i fattori di rischio della patologia.
- il paziente viene istruito e motivato a una corretta igiene orale domiciliare;
- viene eseguito un counseling che promuova stili di vita sani, soprattutto per quanto concerne il fumo, l’alimentazione e lo stress;
- vengono rimossi nella fase di terapia attiva la placca batterica sopra e sottogengivale e i fattori di ritenzione del biofilm;
- si esegue una rivalutazione dello stato di salute parodontale, controllando l’avvenuta guarigione.
Se gli obiettivi di stabilità parodontale sono stati raggiunti, il paziente entra in una terapia di supporto; se ciò non è avvenuto, può essere necessaria una nuova strumentazione, oppure una terapia chirurgica correttiva. Quest’ultimo scenario si presenta più frequentemente negli stadi più gravi (stadio III), e nello stadio IV l’approccio diventa addirittura multidisciplinare al fine ripristinare la funzione masticatoria (16).
PARODONTITE E DIABETE: UNA RELAZIONE A DUE VIE
Il legame tra parodontite e diabete trova ampio consenso in letteratura. Le due patologie si influenzano vicendevolmente, tanto che tra esse è stata ipotizzata una relazione a due vie.
Da un lato lo scarso controllo glicemico è associato a una maggiore incidenza di parodontite, a un peggioramento clinico della stessa, nonché a esiti peggiori del trattamento; dall’altro lato la malattia parodontale predispone a un maggior rischio di prediabete e diabete e a un peggioramento delle complicanze correlate (4).
Il legame diabete-parodontite
L’aumento della suscettibilità alla parodontite del paziente diabetico trova spiegazione nei meccanismi mediati dall’iperglicemia che inducono sia una risposta immunitaria deficitaria, sia un aumento dello stress ossidativo e dell’infiammazione con impatti sul decorso della malattia e sulla disbiosi a livello del biofilm (17). In particolare, il diabete influenza il profilo citochinico e l’azione dei mediatori dell’infiammazione, impattando sulla distruzione del supporto parodontale (L-1β, TNF-α, IL-6, proporzione tra attivatore del recettore del fattore nucleare kappa B ligando e osteoprotegerina); inoltre, in chi è affetto da diabete si assiste a un’azione immunitaria deficitaria, come da parte dei neutrofili a livello gengivale. Nel diabete la glicosilazione delle proteine e i suoi prodotti (AGEs advanced glycation end-products) inducono stress ossidativo che influenza negativamente la malattia parodontale. Infine, lo scarso controllo metabolico ha conseguenze anche a livello tissutale: nel paziente diabetico è stato trovato un alto numero di proteine RANKL (membrane receptor activator of nuclear factor kappa-B ligand) che alterano il metabolismo osseo, inducendone il riassorbimento; inoltre, si assiste a una ridotta produzione di collagene associata a un aumento dell’attività collagenolitica dei fibroblasti a livello parodontale (4,18).
Il legame parodontite-diabete
In letteratura è possibile trovare ampio consenso circa il fatto che i soggetti affetti da malattia parodontale mostrino un peggior controllo glicemico, tanto da supporre che la parodontite possa aumentare significativamente il rischio di sviluppare diabete. A questo proposito, sulla base di una recente metanalisi (19) è stato evidenziato come la presenza di parodontite sia legata a un aumento di emoglobina glicata in soggetti non diabetici, nonché a un deterioramento di FBG (Fasting Blood Glucose) e/o OGTT (Oral Glucose Tolerance Test); con un’evidenza più modesta, anche nei soggetti che hanno già ricevuto una diagnosi di DMT2 il controllo glicemico in termini di HbA1c sembra essere peggiore in presenza di parodontite. Inoltre, soggetti diabetici (DMT2) affetti da parodontite grave (stadi 3 e 4) mostrano un incremento dello 0,1% di emoglobina glicata a 5 anni, al netto di fattori confondenti (20). Per quanto concerne il DMT1 non vi è ancora una solida evidenza sul legame tra parodontite, resistenza insulinica e aumento della glicemia.
In riferimento alle complicanze del DMT2, i soggetti affetti da parodontite mostrano un rischio maggiore di sviluppare danni vascolari, retinopatia e macroalbuminuria; inoltre, in presenza di parodontite severa, il rischio di morte per complicanze cardio-renali aumenta di 3,5 volte (19, 21).
I meccanismi che giustificano il legame tra malattia parodontale e diabete trovano riscontro nell’elevata infiammazione sistemica che caratterizza il soggetto affetto da parodontite. In particolare, la presenza di citochine proinfiammatorie concorre all’insulino-resistenza in associazione all’alterazione della funzione adipocitaria e allo stress ossidativo (19).
La terapia non chirurgica (eziologica) della parodontite si è dimostrata efficace nel migliorare il controllo glicemico in termini di diminuzione del valore dell’emoglobina glicata e nel ridurre l’infiammazione sistemica.
A tre mesi dalla terapia parodontale, il valore metanalitico della riduzione di emoglobina si attesta da 0,4 a 1,1%, sebbene l’attuazione di un protocollo operativo più “intensivo” (caratterizzato da rimozione dei depositi sottogengivali, accesso chirurgico alle tasche residue e terapia di supporto del paziente ogni 3 mesi) sembrerebbe poter promuovere miglioramenti ancora maggiori. Sulla base di questi dati, è possibile affermare che il trattamento della malattia parodontale possa produrre benefici assimilabili all’assunzione di un farmaco ipoglicemizzante (22).
Caso clinico
In linea con il recente documento guida sul diabete redatto dalla Società Italiana di Parodontologia e Implantologia (SIDP), dall’Associazione medici diabetologi (AID) e dalla Società Italiana di Diabetologia (SID), all’interno del nostro team viene applicato un protocollo di cure parodontali chirurgiche e non chirurgiche che prevede la contemporanea valutazione dei fattori di rischio sistemici e locali correlati alla patologia (23). In tal senso, avvalendosi di un dispositivo medico-diagnostico in vitro (Fig. 1) in grado di rilevare anche l’emoglobina glicata (Cobas B-101; Roche Diagnostics, Monza), abbiamo inserito questa valutazione all’interno dei test e della valutazione del profilo di rischio del singolo paziente per poter elaborare sia la migliore strategia terapeutica sia quella di counselling motivazionale.
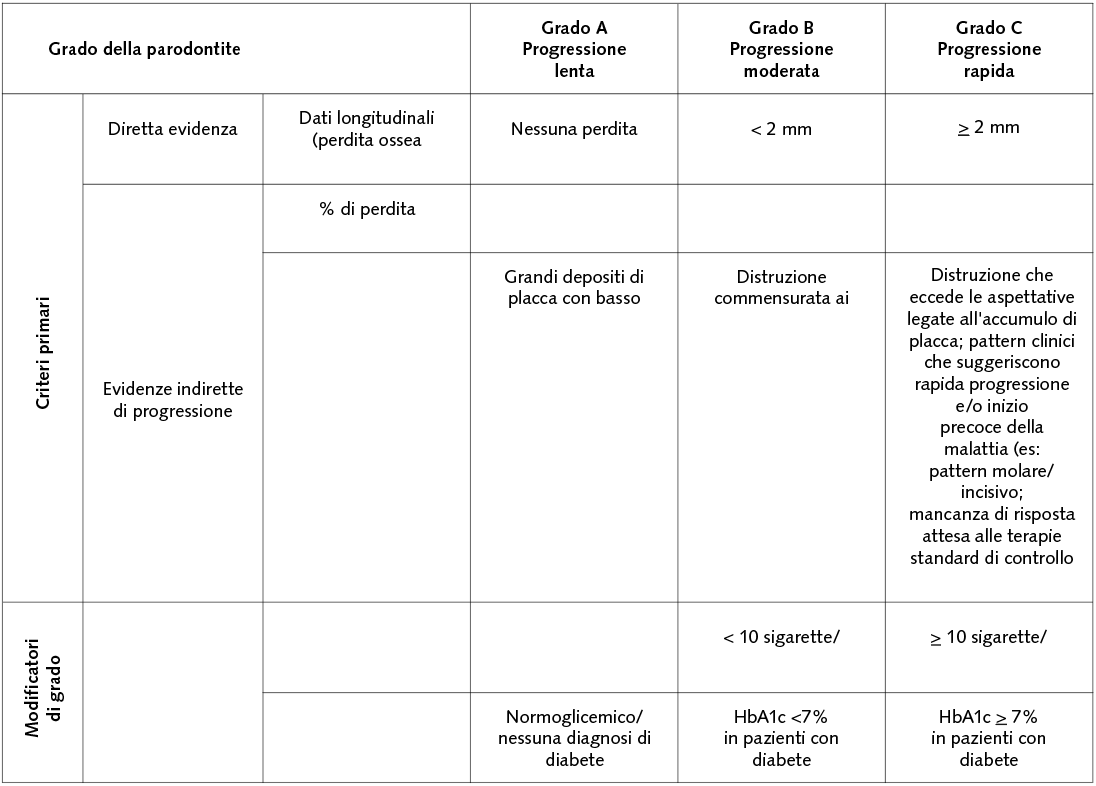
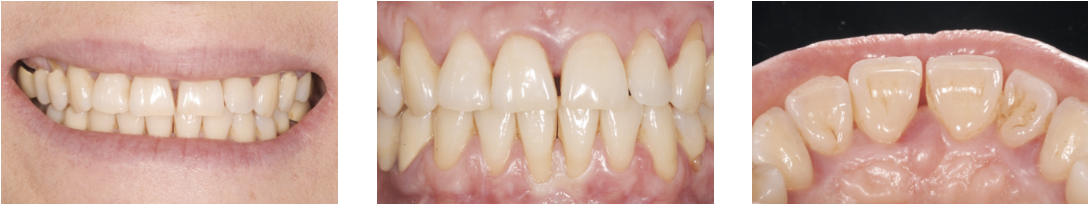
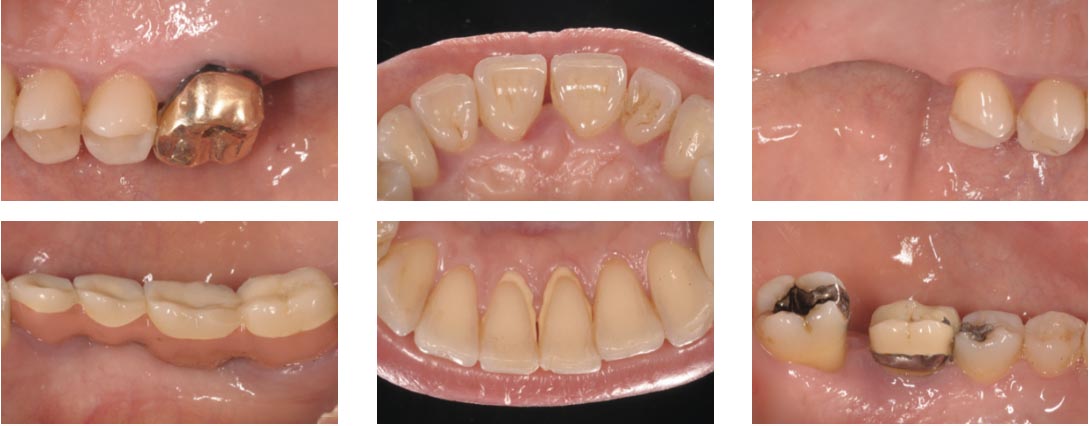
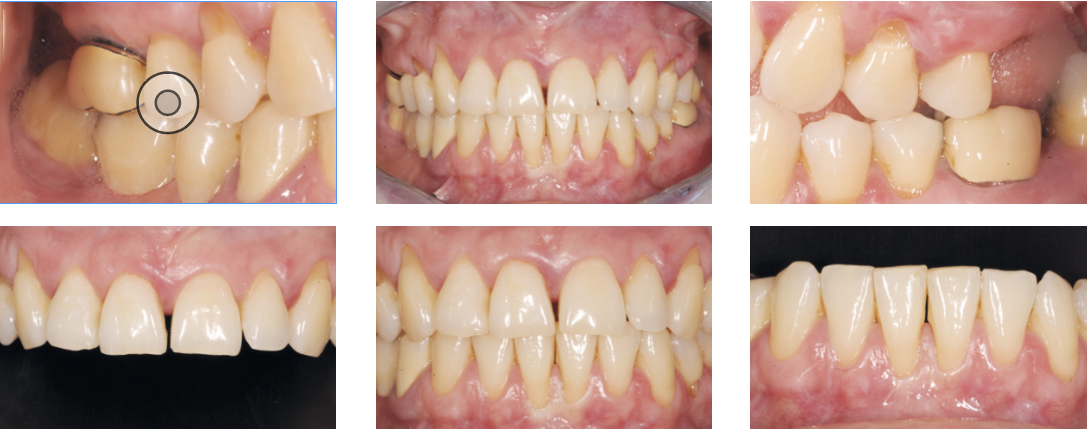
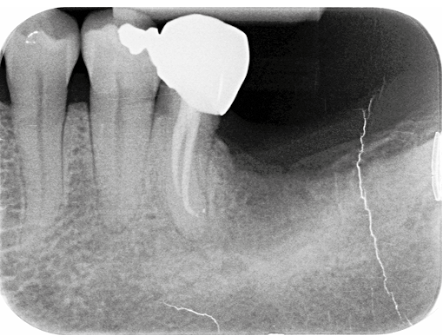
La paziente, donna di 52 anni, si è presentata alla nostra osservazione per l’apertura di un diastema nel II sestante: l’esame obiettivo durante la prima visita ha portato alla diagnosi di una parodontite di stadio III e di grado C (Fig. 2); l’approfondimento diagnostico è stato di ausilio per meglio definire le caratteristiche dei difetti nei vari sestanti, le profondità di sondaggio, la mobilità dei denti. Il momento comunicativo-educativo delle sedute iniziali ha evidenziato una paziente con personalità collaborante che in passato ha vissuto momenti di grande stress, attualmente maggiormente sotto controllo.
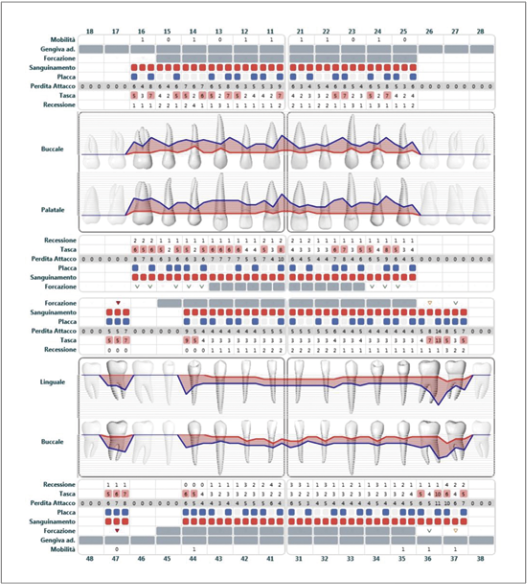
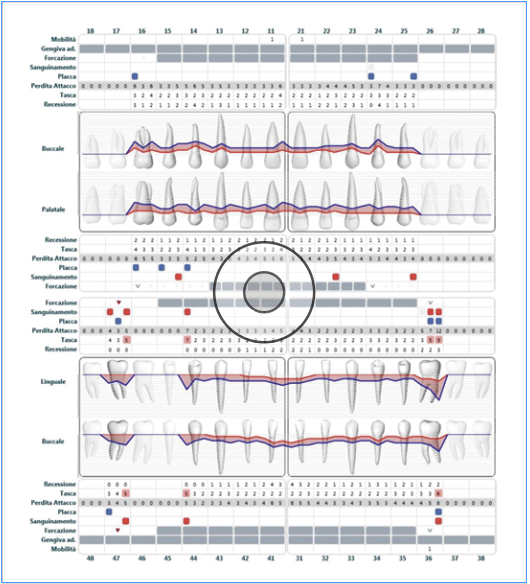
Le recenti linee guida europee supportano la rilevazione dello status endorale completo nella compilazione della cartella parodontale evidenziando gli indici (profondità di sondaggio PD, recessione gengivale REC, perdita di attacco CAL, mobilità M, sanguinamento al sondaggio BOP, grado di coinvolgimento delle forcazioni FUR, e suppurazione SUP) (Fig. 3, 4) (16).
Prima dell’esecuzione della terapia non chirurgica la paziente viene educata alle corrette manovre di igiene orale domiciliare, motivata all’utilizzo dello spazzolino elettrico e dei presidi interprossimali individualizzati (scovolini) per ottenere un adeguato controllo di placca sopragengivale che permetta la strumentazione non chirurgica in assenza di corposi depositi e di elevata carica batterica; è in questa fase che viene anche rilevato il valore dell’emoglobina glicata che nella paziente è risultato essere del 5,7% equivalente a 39 mmol. Tale valore viene considerato come prediabetico (Hba1c ≥5,7% ≥39 mmol): è stato quindi consegnato alla paziente il decalogo informativo sulle correlazioni tra diabete e parodontite della SIDP (Fig. 5).

Oltre alle istruzioni di igiene orale, in questa fase è assolutamente necessario promuovere l’adozione di stili di vita corretti anche per migliorare i valori metabolici sopra indicati. In soggetti che presentino una condizione prediabetica è opportuno far compilare un apposito questionario (Fig. 6) volto a indagare:
- eventuale familiarità per il diabete di tipo II;
- attività fisica eseguita;
- appartenenza a gruppi etnici a rischio;
- valori di ipertensione arteriosa (≥140/90) o terapia antipertensiva in atto;
- bassi livelli di colesterolo HDL (<35mg/dl) o elevati valori di trigliceridi (>250 mg/dl);
- pregresso diabete gestazione nelle donne; ovaio policistico;
- evidenza clinica di malattie cardiovascolari.

La paziente, presentando un valore soglia, deve essere informata sull’associazione tra malattia parodontale e patologie sistemiche (cardiovascolari, dismetaboliche, reumatologiche), tra cui il diabete, va monitorato l’indice di massa corporea (BMI:< 25 kg/m2) e per la tipologia di dieta abituale e in assenza di esami ematochimici recenti (ultimo anno) risulta opportuno chiederne l’esecuzione al medico di base. Non trattandosi di diabete conclamato, non è necessario riferire al diabetologo, ma è opportuno comunicare con il medico di base e condividere valori, indici e fattori di rischio con il soggetto che si sta per avvicinare alla terapia parodontale.
Nel presente caso la paziente è stata sottoposta ad accurate rilevazioni fotografiche della situazione iniziale (Fig. 7, 8) ed è stata quindi programmata la terapia non chirurgica eseguita in una unica seduta (durata circa 3 ore), eseguita quasi esclusivamente con l’utilizzo di ultrasuoni con inserti mininvasivi (24) e l’operatore ha eseguito l’intera strumentazione avvalendosi di dispositivi di ingrandimento (4,5 X) dotati di illuminazione aggiuntiva.
Prima di procedere alla strumentazione ultrasonica, le aree sopragengivali sono state sottoposte a terapia eziologica meccanica utilizzando un dispositivo air abrasioni con eritritolo (Air Flow Plus, EMS).
Il protocollo successivo alla strumentazione ha previsto da parte dell’igienista dentale periodici controlli delle zone sopragengivali strumentate a cadenza di 15 giorni, 30 giorni, 45 giorni, 60 giorni (Fig. 9) con rivalutazione degli indici e della guarigione a due mesi (Fig. 10).
Giunti alla rivalutazione è stato nuovamente registrato il valore della HbA1c, in questo caso sceso a 5,6% 38 mmol.
Successivamente, all’ultimo appuntamento con l’igienista dentale e dopo una discussione tra parodontologo e igienista stesso, la paziente è stata rivista dal parodontologo per una verifica della congruità degli indici rilevati e per la valutazione medica della guarigione dei siti al fine di definire la necessità di terapia parodontale non chirurgica aggiuntiva (retreatment) ed elaborare il piano di trattamento successivo a questa prima fase.
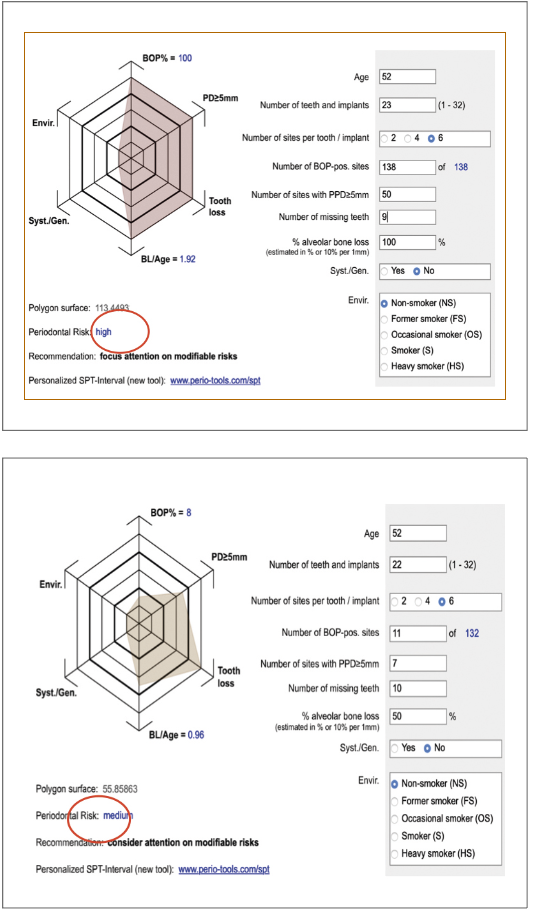
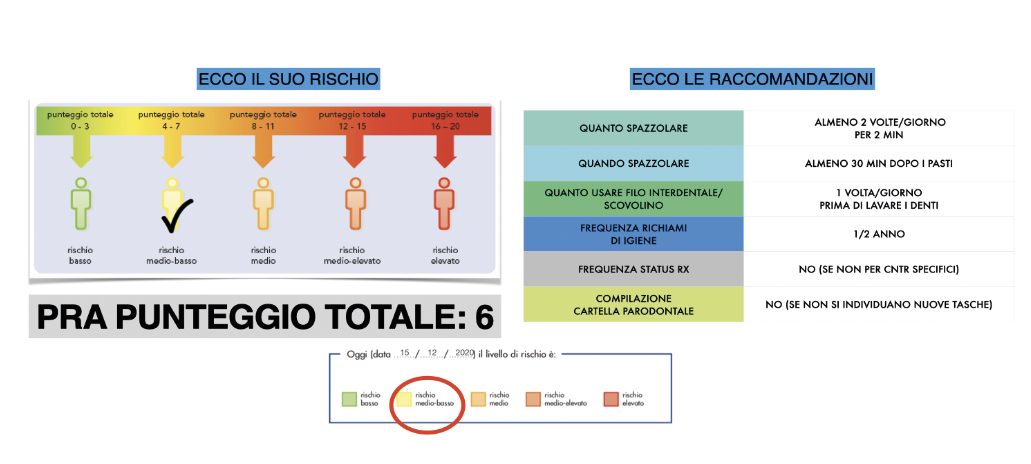
Il team a questo scopo utilizza abitualmente un documento in formato keynote contenente i dettagli iconografici, radiologici e gli indici parodontali rilevati, gli stessi elaborati sulla base del PRA (periodontal risk assessment), in questo caso sia quello della scuola di Berna (Lang e Tonetti) (Fig. 11) che, al termine, quello della scuola di Ferrara (26) (Fig. 12).
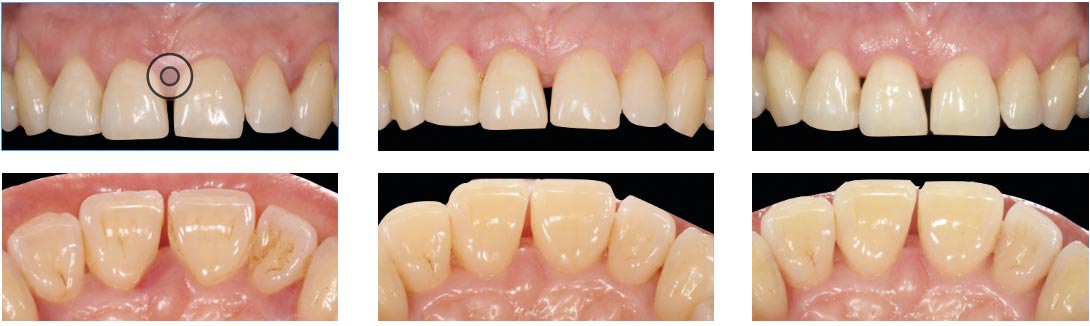
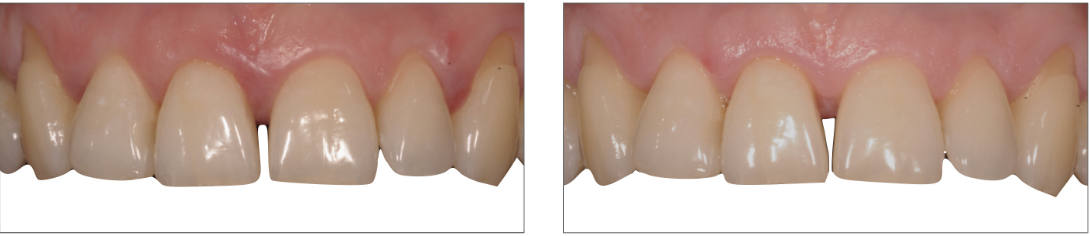
Nel caso specifico la paziente è stata sottoposta a un retreatment nella sede del difetto a carico dell’incisivo superiore di destra (elemento 1.1): questa zona ha notevolmente beneficiato della terapia non chirurgica e della correzione del TDO secondario attraverso un modesto aggiustamento occlusale. Evidenza di ciò appare sia negli indici riportati in CP2 (seconda cartella parodontale) che nell’immagine che evidenza già dalle prime settimane la parziale chiusura del diastema creatosi nel momento della fase attiva della patologia (Fig. 13).
Il piano di trattamento definitivo ha previsto, oltre al ritrattamento dei siti con PD ≥5 mm e alla sua ulteriore rivalutazione, le seguenti terapie.
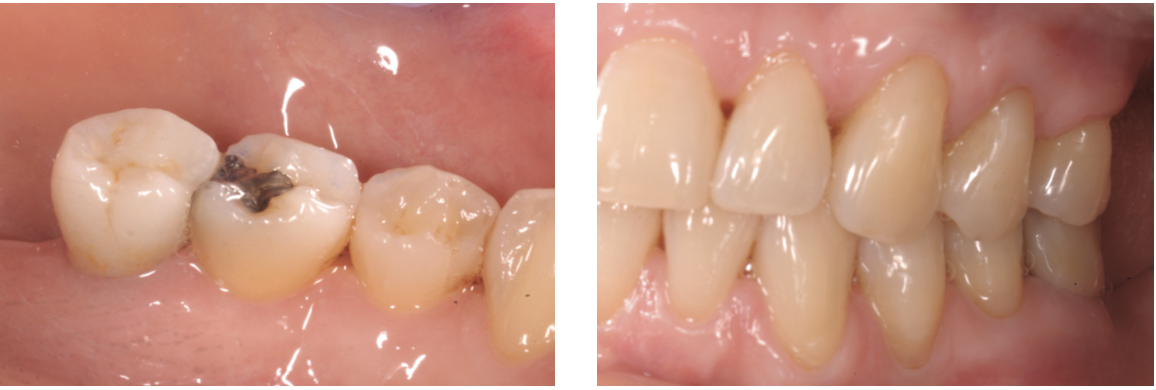
Restauro dei difetti cervicali non cariosi a 13-14-23-24-34-25.
Rizectomia della radice distale di 36, ritrattamento endodontico della radice mesiale, sua ricostruzione conservativa, provvisorizzazione dell’elemento premolarizzato e attesa della maturazione della guarigione dei tessuti.
Protesizzazione definitiva dell’elemento 36 premolarizzato: non era necessario aumentare la superficie occlusale distalmente per presenza di contatti fino al secondo premolare dell’arcata antagonista del secondo quadrante (da 21 a 25) (Fig. 14, 15).
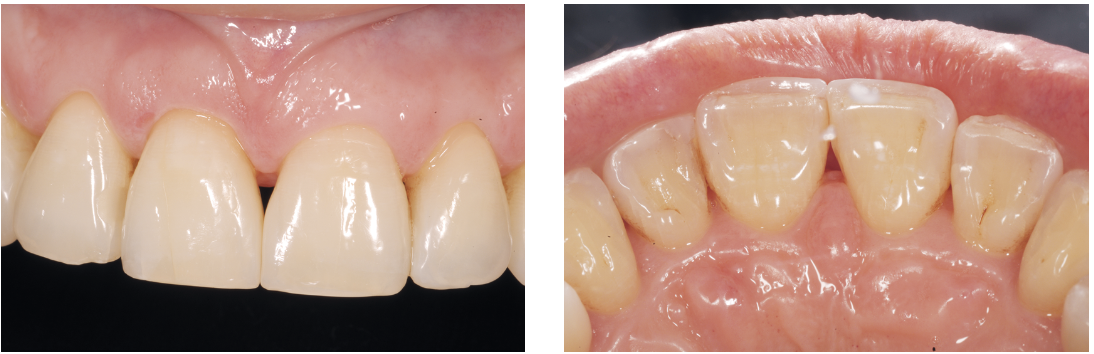
Ricostruzioni estetiche dirette nelle sedi 13-11-21-22 ad ottimizzazione del risultato estetico e a chiusura del minimo diastema residuo (Fig. 16).
Bite occlusale di stabilizzazione per ottimizzare il controllo del trauma secondario e delle saltuarie parafunzioni riferite dal soggetto nei counselling periodici.
La paziente con la terapia ha quindi raggiunto quasi tutti gli obiettivi parodontali, medici e comportamentali che l’attento protocollo proposto implica e vuole perseguire:
- controllo dell’infezione, buon controllo di placca domiciliare (FMPS 8%, FMBS 8%);
- presenza di soli 4 siti di PD ≥5 mm nella zona del sesto sestante, dove la paziente non vuole a oggi procedere all’eliminazione del manufatto protesico esistente, BoP ≤10% (remissione/controllo della malattia parodontale);
- assenza di abitudine al fumo;
- migliore controllo metabolico (valore HbA1c rientrato al di sotto della soglia di prediabete);
- buone regole alimentari, regolare attività fisica;
- miglioramento della morfologia dei difetti ossei profondi;
- ottimizzazione dei punti di contatto ed estetica;
- controllo della mobilità e delle parafunzioni.
In base all’elaborazione dei PRA il rischio di progressione della malattia in questo soggetto risulta da medio basso a medio a seconda del modello statistico di rischio a cui si fa riferimento.
CONCLUSIONI
lo studio odontoiatrico è annoverabile tra le strutture mediche professionali routinariamente frequentate dalla popolazione; ciò fa individuare il setting odontoiatrico cruciale per indirizzare il paziente verso una intercettazione precoce delle condizioni prediabetiche e per effettuare, in presenza di diagnosi di diabete di tipo 2, un attento counseling motivazionale volto a una corretta alimentazione e al mantenimento di adeguati stili di vita (14). L’individuazione dei fattori di rischio sistemici e comportamentali correlati allo sviluppo della parodontite è fondamentale per un corretto approccio terapeutico nel paziente affetto da malattia parodontale, indipendentemente dai valori di stadio e di grado diagnosticati.
La conoscenza del valore dell’emoglobina glicata del paziente affetto da parodontite o comunque intercettato come soggetto a rischio di patologia diabetica permette il precoce controllo metabolico e, di conseguenza, la duplice diminuzione del rischio di sviluppo o peggioramento della parodontite così come del diabete di tipo II.
ABSTRACT
Aim Periodontal disease is one of the most common chronic non-communicable diseases and is a real public health problem. One of the most confirmed correlations concerns periodontal disease and diabetes, and the bidirectional link existing between the two pathologies. The high prevalence of periodontitis combined with the fact that the dental office is one of the professional medical facilities routinely frequented by the population, make the dental setting crucial for directing the patient towards an early diagnosis of pre-diabetes or type 2 diabetes. The aim of this article is to describe, through a case report, the protocol implemented in our dental office for the early diagnosis of diabetes and prediabetes.
Case report
The protocol implemented in our dental office for the treatment of periodontitis is described, which includes the use of an in vitro diagnostic medical device that can also detect glycated hemoglobin. This protocol, which has the dental hygienist within a structured and dynamic team, allowed the early diagnosis of diabetes in a patient with stage III and grade C periodontitis.
Conclusion
The detection of the glycated hemoglobin of patients with periodontitis or intercepted as a subject at risk of diabetes allows an early metabolic control, thus reducing the risk of developing or worsening of both periodontitis and of type II diabetes. The work flow of periodontal treatment implemented in our dental offiice also sees the dental hygienist as a protagonist within a structured team.