Introduzione
Le attuali procedure cliniche e la continua ricerca in ambito tecnologico applicate alla chirurgia implantare hanno consentito di raggiungere un buon livello di prevedibilità e successo nell’osteointegrazione degli impianti di moderna concezione, nonché un incremento della loro sopravvivenza a lungo termine. Se da un lato è essenziale adottare tecniche chirurgiche in grado di creare le condizioni per un’osteointegrazione adeguata senza contaminazioni batteriche che possano portare a complicanze, dall’altro è estremamente importante il mantenimento igienico domiciliare e professionale di tali manufatti nonché un analogo accurato follow-up da parte degli operatori del settore (1-2).
Prevenire l’insorgenza di lesioni, in primis mucosite e perimplantite, è possibile mediante l’adozione di protocolli operativi igienici in grado di mantenere i tessuti molli perimplantari in salute ed evitare che si vengano a creare quadri patologici che mettano a rischio la stabilità dell’impianto stesso (3).
Al fine di mantenere al meglio lo spazio biologico perimplantare è necessario conoscere le caratteristiche delle superfici con cui si interfacciano le strutture implantari (abutment e collo implantare) con i tessuti parodontali. Superfici lisce o ruvide possono influenzare positivamente o negativamente il processo patologico o la guarigione dei tessuti stessi (4).
La maggior parte degli strumenti utilizzati per il mantenimento e/o trattamento delle superfici implantari sono stati studiati per non alterare quest’ultima e favorire l’eliminazione dei fattori eziologici come il tartaro e il biofilm batterico (5). La presenza di scanalature, scalfitture, graffi od altre alterazioni superficiali dovute alla strumentazione igienica può facilitare l’accumulo di placca e tartaro, fattori in grado di provocare infiammazione tissutale perimplantare (6-7).
Ad oggi molti strumenti e diverse procedure sono stati esaminati per valutarne rischi e benefici.
Lo scopo del presente studio è quello di valutare gli effetti della strumentazione meccanica e manuale sulle superfici implantari in correlazione all’efficacia clinica d’igienizzazione delle superfici stesse, così da fornire un gold standard nella scelta delle procedure professionali di igiene orale in implantoprotesi.
Questo lavoro presenta una revisione sistematica della letteratura al fine di individuare quale sia il gold standard strumentale per il clinico che voglia agire nel modo più opportuno in base alle superfici implantari da trattare.
Materiali e Metodi
Questa revisione sistematica della letteratura è stata condotta in accordo con le linee guida PRISMA-Statement (Transparent Reporting of Systematic Reviews and Meta-Analyses)(8).
Per la ricerca del materiale sono state usate tre banche di dati biomedici accessibili tramite Internet: la National Library of Medicine (MEDLINE-PubMed), la Cochrane Central Register of Controlled Trials (CENTRAL) ed EMBASE (Excerpta Medical Database by Elsevier).
La ricerca del materiale è stata condotta fino a febbraio 2015 escludendo i lavori antecedenti al 1989.
Come studi di riferimento sono stati presi in considerazione le revisioni condotte da Louropoulou et al. (2011-2013) (9, 10).
Per raggiungere questo obiettivo è stata eseguita una ricerca completa della letteratura, prendendo in considerazione tutte le modalità di trattamento per l’igiene delle superfici implantari.
I termini usati nella strategia di ricerca sono riportati nella tabella 1.
| PubMed-MEDLINE, Cochrane-CENTRAL e EMBASE. La ricerca è stata impostata secondo: {MATERIA‹Subject› AND AGGETTIVO‹Adjective› AND INTERVENTO‹Intervention›} |
|---|
| Otti{‹Subject: (dental implants [MeSH terms] OR (dental implant OR {/dental OR oral\ AND implant} [textword]) › AND ‹Adjective: (biofilms OR dental plaque OR dental deposits [MeSH terms] OR smooth OR structure OR texture OR roughness OR surface OR biofilm OR plaque index OR dental plaque OR plaque OR dental deposit OR biocompatibility [textword]) › AND ‹Intervention: (dental scaling OR decontamination OR laser [MeSH terms] OR ultrasonic OR curette OR scaling OR laser OR polishing OR debridement OR curettage OR air abrasion OR air polisher OR cleaning OR instrumentation OR decontamination OR air powder OR bur OR brush OR citric acid OR phosphoric acid OR CPC OR cetylpridinium chloride OR SLS OR sodium lauryl sulphate OR EDTA OR ethylenediaminetetraacetic acid OR chlortetracycline OR demeclocycline OR doxycycline OR lymecycline OR methacycline OR minocycline OR oxytetracycline OR rolitetetracycline OR tetracycline OR tetracyclines OR hydrogen peroxide OR H2O2 OR sodium perborate OR peroxyborate OR peroxycarbonate [textword]) ›}.ma |
I titoli e gli abstract sono stati i primi parametri di selezione della letteratura. Dopo una prima selezione si è proceduto con la lettura completa dei testi selezionati e l’inclusione o l’esclusione di essi secondo criteri prestabiliti (flowchart) (Fig. 1).
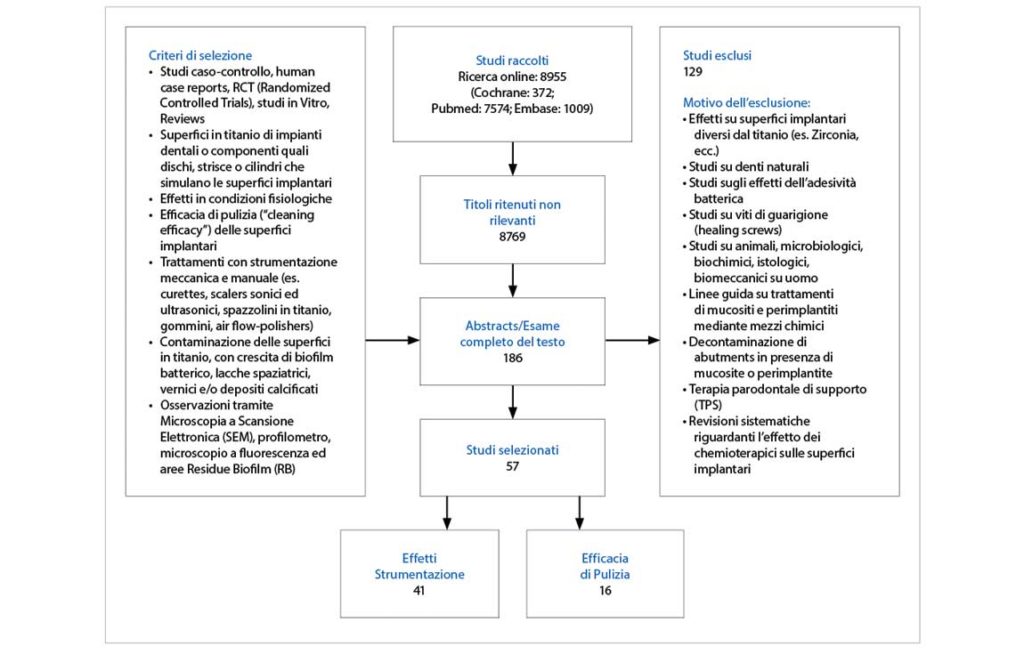
La ricerca iniziale, con i suddetti criteri, ha portato all’individualizzazione di 8955 titoli:
COCHRANE Central 372;
PUBMED Medline 7574;
EMBASE 1009.
Dopo un iniziale screening dei titoli ne sono stati esclusi 8769 e selezionati 186 abstract. La successiva lettura di questi ultimi ha permesso l’eliminazione di altri 129 studi, in quanto non conformi ai criteri di inclusione descritti in precedenza.
In definitiva sono stati selezionati 57 studi per l’estrazione e la valutazione dei dati. I lavori inclusi sono riportati nella tabella 2.
| Effetti strumentazione | anno | rif. biblio |
|---|---|---|
| Thomson-Neal et al. | -1989 | -11 |
| Rapley et al. | -1990 | -12 |
| Fox et al. | -1990 | -13 |
| Kwan et al. | -1990 | -14 |
| Barnes et al. | -1991 | -15 |
| Gantes & Nilveus | -1991 | -16 |
| Koka et al. | -1992 | -17 |
| Homiak et al. | -1992 | -18 |
| McCollum et al. | -1992 | -19 |
| Ruhling et al. | -1994 | -20 |
| Razzoog & Koka | -1994 | -21 |
| Kuempel et al. | -1995 | -22 |
| Hallmon et al. | -1996 | -23 |
| Matarasso et al. | -1996 | -24 |
| Meschenmoser et al. | -1996 | -25 |
| Cross-Poline et al. | -1997 | -26 |
| Brookshire et al. | -1997 | -27 |
| Mengel et al. | -1998 | -28 |
| Mouhyi et al. | -1998 | -29 |
| Bain | -1998 | -30 |
| Augthun et al. | -1998 | -31 |
| Bailey et al. | -1998 | -32 |
| Rimondini et al. | -2000 | -33 |
| Ruhling et al. | -2001 | -34 |
| Matsuyama et al. | -2003 | -35 |
| Schwarz et al. | -2003 | -36 |
| Mengel et al. | -2004 | -37 |
| Sato et al. | -2004 | -38 |
| Kreisler et al. | -2005 | -39 |
| Ramaglia et al. | -2006 | -40 |
| Barbour et al. | -2007 | -41 |
| Kawashima et al. | -2007 | -42 |
| Schwarz et al. | -2009 | -43 |
| Duarte et al. | -2009 | -44 |
| Mann et al. | -2012 | -45 |
| Schmage et al. | -2012 | -46 |
| Unursaikhan et al. | -2012 | -47 |
| Fakhraval et al. | -2012 | -48 |
| Park et al. | -2012 | -49 |
| Hasturk et al. | -2013 | -50 |
| Cochis et al. | -2013 | -51 |
| Efficacia clinica | - | - |
| Parham et al. | -1989 | -52 |
| Gantes & Nilveus | -1991 | -53 |
| Zablotsky et al. | -1992 | -54 |
| Speelman et al. | -1992 | -55 |
| Dennison et al. | -1994 | -56 |
| Pereira da Silva et al. | -2005 | -57 |
| Schwarz et al. | -2005 | -58 |
| Kawashima et al. | -2007 | -59 |
| Schwarz et al. | -2009 | -60 |
| Schmage et al. | -2012 | -61 |
| Tastepe et al. | -2012 | -62 |
| Nemer Vieira et al. | -2012 | -63 |
| Idlibi et al. | -2013 | -64 |
| John et al. | -2013 | -65 |
| Park et al. | -2013 | -66 |
| Marconcini et al. | -2014 | -67 |
Un’ulteriore suddivisione è stata fatta al fine di individuare 41 studi riguardanti gli effetti della strumentazione e 16 riguardo l’efficacia clinica.
Gli strumenti testati risultano produrre effetti diversi in rapporto alle superfici trattate.
Superfici lisce: Polished Smooth Surface (PSS).
Superfici ruvide: Titanium Plasma Sprayed (TPS);
Sand-blasted and Acid-etched (SLA).
Gli effetti e l’efficacia clinica sono stati valutati utilizzando i seguenti parametri:
- 0 nessun cambiamento rispetto al controllo;
- + superfici più lisce o più igienizzate rispetto al controllo;
- – superfici danneggiate o meno igienizzate rispetto al controllo;
- ? superfici che non hanno subito cambiamenti statisticamente significativi (dati non chiari) o se lo strumento testato non mostra chiari effetti sulle superfici trattate.
Nello studio sono stati presi in considerazione esclusivamente l’effetto clinico, inteso come danno alla superficie (damage o effect size), e l’efficacia clinica, intesa come capacità d’igienizzazione (efficacy).
Risultati
I 57 studi hanno come strumento di controllo il SEM (microscopio elettronico a scansione), tra questi 11 hanno utilizzato anche il profilometro (Tabella 3).
| Legenda | n. | AUTORI (aa) | TRATTAMENTO | Controllo | Misura |
|---|---|---|---|---|---|
| Controllo 1 Sezioni superficiali non trattate 2 Superfici contaminate pre-trattamento 3 Abutment non trattati 4 Controllo pre-trattamento 5 Superfici non trattate 6 Dischi in titanio non trattati 7 Collo impianto non trattato 8 Impianto non trattato 9 Superficie abutment Misura A SEM B Profilometro | 1 | Thomson-Neal et al. (1989) | Scaler in titanio. Ultrasuoni con punta metallica. Gommino con pasta. | 1 | A |
| 2 | Parham et al. (1989) | Air-flow con bicarbonato di sodio. | 2 | A | |
| 3 | Rapley et al. (1990) | Scaler in acciaio. Scaler in plastica. Ultrasuoni con punta metallica. Gommini con pasta. | 3 | A | |
| 4 | Fox et al (1990) | Curette in acciaio. Curette in titanio. Curette in plastica. | 1 | A, B | |
| 5 | Kwan et al. (1990) | Ultrasuoni con punta metallica. Ultrasuoni con punta in plastica. | 1 | A | |
| 6 | Barnes et al. (1991) | Air-flow polisher. | 4 | A | |
| 7 | Gantes & Nilveus (1991) | Scaler in plastica- Punta sonica in plastica- Gommini Air-flow con NaHCO3 | 1 | A | |
| 8 | Gantes & Nilveus (1991) | Punta sonica in plastica. | 2 | A | |
| 9 | Koka et al. (1992) | Air-flow A Air-flow B. | 3 | A | |
| 10 | Homiak et al. (1992) | Scaler in acciaio. Scaler in plastica. Gommino. Gommino con pasta Air-flow. | 1 | A | |
| 11 | McCollum et al. (1992) | Scaler in plastica. Gommino con pasta Air-flow. | 1 | A | |
| 12 | Zablotsky et al. (1992) | Punta sonica in plastica. Air-flow con bicarbonato di sodio. | 2 | A | |
| 13 | Speelman et al. (1992) | Curette in metallo. Scaler in plastica. Ultrasuoni con punta metallica. Fresa in composito. Gommino e pomice. | 2 | A | |
| 14 | Ruhling et al. (1994) | Curette in acciaio. Curette in plastica. Curette in oro. Ultrasuoni con punta metallica e non. Sonici. | 1 | A, B | |
| 15 | Razoog et al. (1994) | Air-flow A. Air-flow B. | 5 | A | |
| 16 | Dennison et al. (1994) | Air-flow con bicarbonato di sodio. | 2 | A | |
| 17 | Kuempel et al. (1995) | Curette in acciaio. Curette in lega aurea. Scaler in plastica. | 6 | A | |
| 18 | Hallmon et al. (1996) | Curette in acciaio. Curette in plastica. Scaler in plastica. Punta metallica e non metallica sonica. | 3 | A | |
| 19 | Matarasso et al. (1996) | Curette in acciaio. Curette in titanio. Curette in plastica. Ultrasuoni con punta metallica e non. Air-flow. | 7 | A, B | |
| 20 | Meschenmoser et al. (1996) | Curette in acciaio. Curette in titanio. Curette in plastica. Air-flow. Ultrasuoni con punta metallica. | 1 | A, B | |
| 21 | Cross-Poline et al. (1997) | Curette in lega aurea. Curette in plastica. | 1 | A | |
| 22 | Brookshire et al. (1997) | Curette in metallo. Curette in lega aurea. Curette in plastica. Gommino con pasta Air-flow. | 4 | A | |
| 23 | Mengel et al. (1998) | Curette in acciaio. Curette in titanio. Curetta in plastica. Air-flow. Gommino con pasta. | 8, 9 | A, B | |
| 24 | Mouhyi et al. (1998) | Air-flow. | 8 | A | |
| 25 | Bain (1998) | Scaler non-metallici. | 3 | A | |
| 26 | Augthun et al. (1998) | Curette in acciaio. Curette in plastica. Air-flow. Pasta diamantata-polish. | 8 | A | |
| 27 | Bailey et al. (1998) | Ultrasuoni con punta metallica. Ultrasuoni con punta non metallica. | 1 | A | |
| 28 | Rimondini et al. (2000) | Frese al carburo di tungsteno. Frese diamantate. | 8, 9 | A, B | |
| 29 | Ruhling et al. (2001) | Strisce abrasive diamantate con diversi gradi di ruvidità. | 1 | A, B | |
| 30 | Matsuyama et al. (2003) | Ultrasuoni con punta metallica. | 4 | A | |
| 31 | Schwarz et al. (2003) | Ultrasuoni con punta in fibra di carbonio. | 4 | A | |
| 32 | Mengel et al. (2004) | Curette in acciaio. Curette in titanio. Curette in plastica. Ultrasuoni con punta metallica. Gommino con pasta. | 1 | A, B | |
| 33 | Sato et al. (2004) | Scaler in plastica. Ultrasuoni con punta non metallica. | 3 | A, B | |
| 34 | Kreisler et al. (2005) | Air-flow. | 6 | A | |
| 35 | Pereira da Silva et al. (2005) | Air-flow con bicarbonato di sodio. | 2 | A | |
| 36 | Schwarz et al. (2005) | Ultrasuoni con punta PEEK (polieterterchetone). Pasta Polish. | 2 | A | |
| 37 | Ramaglia et al. (2006) | Curette in acciaio. Curette in plastica. Ultrasuoni con punta metallica. Air-flow. | 8 | A, B | |
| 38 | Barbour et al. (2007) | A: fresa diamantata, carborundum, feltrino e coppetta in silicone. B: coppetta in silicone e feltrino da lucidatura. | 4 | A, B | |
| 39 | Kawashima et al. (2007) | Ultrasuoni con punta non metallica. Ultrasuoni con punta metallica. | 3 | A, B | |
| 40 | Kawashima et al. (2007) | Ultrasuoni con punta metallica. Ultrasuoni con punta in plastica. Ultrasuoni con punta fibra carbonio. | 2 | A | |
| 41 | Schwarz et al. (2009) | Air-flow con carbonato di sodio. | 6 | A | |
| 42 | Schwarz et al. (2009) | Air-flow con amminoacido glicina o bicarbonato di sodio. | 2 | A | |
| 43 | Duarte et al. (2009) | Curette in acciaio. Curette in plastica Air-flow. | 4 | A, B | |
| 44 | Mann et al. (2012) | Ultrasuoni con punta metallica TFI-10. Ultrasuoni con punta in plastica. | 8 | A | |
| 45 | Schmage et al. (2012) | Scaler in metallo. Curette in acciaio. | 6 | A | |
| 46 | Schmage et al. (2012) | Curette in plastica. Curette in carbonio. Sonico con punta PEEK. Air-flow glicina. Gommino con pasta. | 2 | A | |
| 47 | Unursaikhan et al. (2012) | Curette in plastica. Ultrasuoni con punta metallica. Ultrasuoni con punta non metallica. | 6 | A | |
| 48 | Fakhraval et al. (2012) | Scaler in metallo. Scaler in plastica. | 3 | A, B | |
| 49 | Park et al. (2012) | Ultrasuoni con punta metallica. Ultrasuoni con punta in plastica. Spazzolino con dentifricio. | 6 | A | |
| 50 | Tastepe et al. (2012a,b) | Air-flow con: A) biossido di titanio-TiO2; B) glicina; C) idrossiapatite-HA; D) fosfato di calcio. | 2 | A | |
| 51 | Nemer Vieira et al. (2012) | Air-flow con bicarbonato di sodio. | 2 | A | |
| 52 | Hasturk et al. (2013) | Scaler in plastica. Scaler in metallo. Scaler rivestiti in resina rinforzata. | 3 | A | |
| 53 | Cochis et al. (2013) | Air-flow con amminoacido glicina. Air-flow con bicarbonato di sodio. | 6 | A | |
| 54 | Idlibi et al. (2013) | Air-flow con amminoacido glicina. | 2 | A | |
| 55 | John et al. (2013) | Spazzolino in titanio. Curette in acciaio. | 2 | A | |
| 56 | Park et al. (2013) | Ultrasuoni con punta metallica. Spazzolino da profilassi. | 2 | A | |
| 57 | Marconcini et al. (2014) | Air-flow Curette in acciaio. | 2 | A |
Un’ulteriore suddivisione è stata fatta in base alla struttura superficiale delle componenti implantari testate. Sono state valutate fondamentalmente due tipologie di superficie: lisce e ruvide.
Le superfici ruvide analizzate sono state ottenute con due metodiche di trattamento: TPS (Titanium Plasma Sprayed) e SLA (Sandblasted and Acid-Etched).
I lavori selezionati sono nella quasi totalità studi in vitro (in tutto 53), fatta eccezione per 2 studi in vivo su modello animale (Gantes e Nilveus, 1991; Speelman et al., 1992) e 2 studi in vivo su modello umano (Kawashima et al., 2007; Marconcini et al., 2014).
Sono state valutate diverse strutture implantari: abutment, corpo e collo dell’impianto, ovvero superfici in grado di simulare componenti implantari quali dischi, lamine o cilindri in titanio. Per questo motivo non sono state prese in considerazione le case produttrici dei dispositivi implantari, ma solo le caratteristiche strutturali e superficiali dei diversi tipi di impianti.
| n. | CONCLUSIONI |
|---|---|
| 1 | Ripetuti trattamenti hanno effetti deleteri sulle superfici. Il gommino con pasta risulta il meno lesivo. |
| 2 | Le superfici trattate con NaHCO3 mostrano il 100% di rimozione della placca batterica. |
| 3 | Lo scaler e la punta ultrasonica metallica creano gravi ruvidità superficiali. Il gommino con pasta rende liscia la superficie. Nessun effetto con scaler in plastica. |
| 4 | Gli strumenti in plastica non alterano le superfici implantari. Gli strumenti metallici alterano significativamente le superfici. |
| 5 | La punta ultrasonica in plastica è un dispositivo promettente per il mantenimento implantare. Può creare solcature superficiali, rimovibili tramite tecnica polish. |
| 6 | Nessuna differenza significativa è stata notata al SEM rispetto al controllo pre-trattamento, riguardo l’integrità superficiale. |
| 7 | Air-flow con Bicarbonato di Sodio è sconsigliato per il mantenimento degli impianti in titanio. |
| 8 | La punta sonica in plastica è in grado di rimuovere completamente le contaminazioni batteriche presenti sulle superfici in titanio lisce. |
| 9 | Entrambe le superfici sembrano essere più lisce rispetto al controllo e resistenti alla formazione di placca. Residui non cristallini compaiono sulle superfici trattate con air-flow B. |
| 10 | Lo scaler metallico irruvidisce le superfici lisce in titanio. Le altre modalità lisciano le superfici in titanio rimuovendo e arrotondando i detriti superficiali presenti nella struttura originaria. |
| 11 | Per il mantenimento e la profilassi questi strumenti possono essere usati senza danneggiare la superficie. |
| 12 | Entrambi i trattamenti riducono la quantità di biofilm superficiale rispetto al controllo. Air-flow al NaHCO3 rimuove più biofilm rispetto alla punta sonica in plastica. |
| 13 | La lucidatura settimanale con gommino e pomice rende le superfici più pulite. Scaler in plastica e fresa in composito puliscono meno. Nessuno scaler igienizza meglio degli altri tre. |
| 14 | Nessun danno percettibile sulle superfici lisce in titanio è causato da sonici e ultrasonici con punta non metallica. Residui di materiale degli strumenti si riscontrano sulle superfici ruvide. |
| 15 | Nessuno dei due sistemi testati sembra causare abrasioni significative sulle superfici degli abutments in titanio. |
| 16 | Significativa decrescita dei livelli di endotossine sulle superfici dopo il trattamento. Air-flow risulta più efficace nella rimozione delle endotossine del biofilm sulle superfici TPS e machined. |
| 17 | La curette in acciaio e la curette in lega aurea portano drastiche alterazioni della caratteristiche superficiali del titanio. |
| 18 | Lo scaler in plastica sembra essere lo strumento idoneo per il debridement delle superfici dell’abutment. Il primo obiettivo è preservare l’integrità superficiale. |
| 19 | La curette in acciaio, in titanio, la punta ultrasonica metallica e l’air flow incrementano la ruvidità superficiale e devono essere evitati. Si preferiscono strumenti non dannosi per le superfici. |
| 20 | La curette in acciaio e gli ultrasuoni sono totalmente inadatti all’igienizzazione delle superfici in titanio. |
| 21 | La curette in lega aurea crea la superficie più ruvida. |
| 22 | Nessuna significativa alterazione superficiale è stata prodotta dal sistema air-flow. Tutti gli altri sistemi creano danni superficiali e a volte lasciano residui strumentali. |
| 23 | L’air-flow, il gommino e la curette in plastica possono essere usati per la rimozione della placca e del tartaro sopragengivale sulle superfici implantari senza creare danni. |
| 24 | Il trattamento con air-flow degli impianti ha portato a cambiamenti topografici, ma minimi delle superfici. |
| 25 | Lo scaler non metallico causa meno danni sugli abutmets. |
| 26 | L’air-flow e la curette in plastica causano minime se non nulle alterazioni superficiali degli impianti. |
| 27 | Le superfici TPS (Titanium Plasma-Sprayed) mostrano importanti alterazioni superficiali dopo l’uso di entrambe le punte ultrasoniche. |
| 28 | La rimozione più efficace del TPS è stata ottenuta con granulometria rispettivamente di 30/15 µm per le frese diamantate e 16/12 µm per le frese al carburo, in sequenza. |
| 29 | I risultati mostrano che è possibile rimuovere il rivestimento TPS tramite questi strumenti. E’prevedibile la contaminazione superficiale con materiale strumentale. |
| 30 | La superficie dell’abutment è stata danneggiata per i danni meccanici creati durante la strumentazione dalla punta metallica ultrasonica. |
| 31 | Tutte le superfici trattate con la punta in fibra di carbonio mostrano evidenti danni superficiali e presenza di detriti strumentali. |
| 32 | Gli ultrasuoni e le curettes in metallo e titanio lasciano pronunciate tracce sulle superfici lisce e aumentano l’Rz (deviazione del profilo superficiale). Ottima rimozione. |
| 33 | Gli ultrasuoni con la punta non metallica non producono danni significativi sulle superfici implantari in titanio. Gli scalers in plastica sono idonei per il mantenimento implantare. |
| 34 | Air-flow può portare a cambiamenti nella morfologia delle superfici in titanio. |
| 35 | Dopo l’applicazione del protocollo di decontaminazione, nessuna cellula vitale è stata rilevata dalle superfici TPS esaminate. |
| 36 | I campioni trattati con la punta PEEK mostrano una significativa riduzione delle aree ricoperte da biofilm, su superfici SLA. |
| 37 | Sebbene la curette in plastica e l’air-flow creino minori alterazioni superficiali, lasciano depositi superficiali che possono avere, in vivo, effetti sul processo di guarigione dei tessuti. |
| 38 | Il protocollo polish B è da preferire a quello A in quanto meno materiale è stato rimosso e vi è minor possibilità di creare aree ruvide. |
| 39 | La punta ultrasonica non metallica non altera le superfici dell’abutment.Queste punte ultrasoniche sono adatte al mantenimento implantare. |
| 40 | Vi è una netta differenza nella riduzione di placca e tartaro tra il trattamento e il controllo. Nessuna differenza è stata riscontrata in base alla strumentazione usata. |
| 41 | Dopo trattamenti ripetuti, il carbonato di sodio crea evidenti alterazioni superficiali. |
| 42 | Tutte le polveri air-flow testate sono ugualmente efficaci sulla superficie in titanio SLA. |
| 43 | La curette in metallo non è consigliata per le superfici lisce. Le superfici ruvide trattate con air-flow e curette in metallo creano minor adesione batterica per modificazioni superficiali. |
| 44 | La punta metallica crea difetti sulle superfici implantari ed il carico e la potenza sono fattori importanti. La punta in plastica lascia detriti e crea lievi danni avendo un’azione polish. |
| 45 | Gli strumenti metallici creano ruvidità superficiali. |
| 46 | La maggior igienizzazione delle superfici è stata ottenuta dopo l’uso dell’air-flow glicina e la punta sonica PEEK. La peggiore, invece, dopo l’uso della curette in carbonio. |
| 47 | La punta ultrasonica metallica crea ruvidità superficiali. Nonostante ciò, rimuove molto più biofilm batterico rispetto agli altri due sistemi testati. |
| 48 | Lo scaler in plastica e in metallo possono causare ruvidità superficiali. Lo scaler in metallo crea ruvidità superficiali maggiori. |
| 49 | La punta ultrasonica in plastica e metallica non creano danni sulle superfici SLA. La punta metallica crea irregolarità su superfici machined. Lo spazzolino rende le superfici più lisce. |
| 50 | Le polveri air-flow di fosfato di calcio, di idrossiapatite e glicina possono rimuovere quasi totalmente il biofilm dalla superfici SLA. Il TiO2 è meno efficiente. |
| 51 | Dopo l’applicazione del protocollo di decontaminazione, la maggior parte delle specie batteriche sono state rimosse dagli impianti testati, indipendentemente dalle ruvidità superficiali. |
| 52 | Gli effetti degli scalers variano in base al tipo di abutment ed alla sua superficie.Lo scaler in resina rinforzata crea maggior ruvidità superficiale su superfici lisce. Tutti possono creare danni. |
| 53 | L’air-flow glicina può essere considerato il miglior metodo per la rimozione della placca dalle superfici implantari in quanto meno aggressivo rispetto al NaHCO3 e batteriostatico. |
| 54 | L’air-flow glicina mostra la maggior efficacia nella rimozione del biofilm orale. La percentuale del biofilm residuo è del 2,5% rispetto al controllo. |
| 55 | Entrambe le procedure d’igiene mostrano una significativa decrescita delle aree residue di biofilm. Lo spazzolino in titano è più efficacie nella rimozione rispetto alla curette in acciaio. |
| 56 | Gli ultrasuoni con punta metallica rimuovono il biofilm batterico quasi nella totalità. Lo spazzolino da profilassi rende le superfici lisce. |
| 57 | L’air-flow è in grado di rimuovere più biofilm rispetto alla curette in acciaio. Tutti i sistemi valutati non inducono modificazioni dell’abutment. |
La valutazione dell’efficacia clinica della strumentazione professionale è stata quantificata e misurata, contaminando le superfici implantari con vernici o colture biologiche che simulavano il biofilm batterico.
In 3 studi la contaminazione è avvenuta tramite l’utilizzo di lipopolisaccaridi rilasciati dai batteri Escherichia coli o dal Porphyromonas gingivalis (Zablotsky et al., 1992; Dennison et al., 1994; Park et al., 2013).
Quattro studi prendono in considerazione singole specie batteriche come ad esempio lo Streptococcus mutans o lo Streptococcus sanguis (Schmage et al., 2012; Pereira da Silva et al., 2005; Nemer Viera et al., 2012; Parham et al., 1989).
In 9 studi, invece, la superficie in titanio è stata contaminata con placca sopragengivale in cani Beagle (Gantes e Nilveus, 1991; Speelman et al., 1992; Schwarz et al., 2005, 2009; Tastepe et al., 2012 a/b; Baek et al., 2012; Idlibi et al., 2013; John et al., 2013).
Solo in 2 studi è presente la contaminazione superficiale con placca sopragengivale umana (Kawashima et al. 2007, Marconcini et al. 2014).
In tutti gli studi il periodo di accumulo di placca varia considerevolmente (da 24 ore a 16 giorni).
Si è proceduto a raggruppare in una tabella (Tab. 4) i diversi strumenti testati così da poter valutare l’efficacia clinica e gli effetti degli stessi sulle superfici implantari.
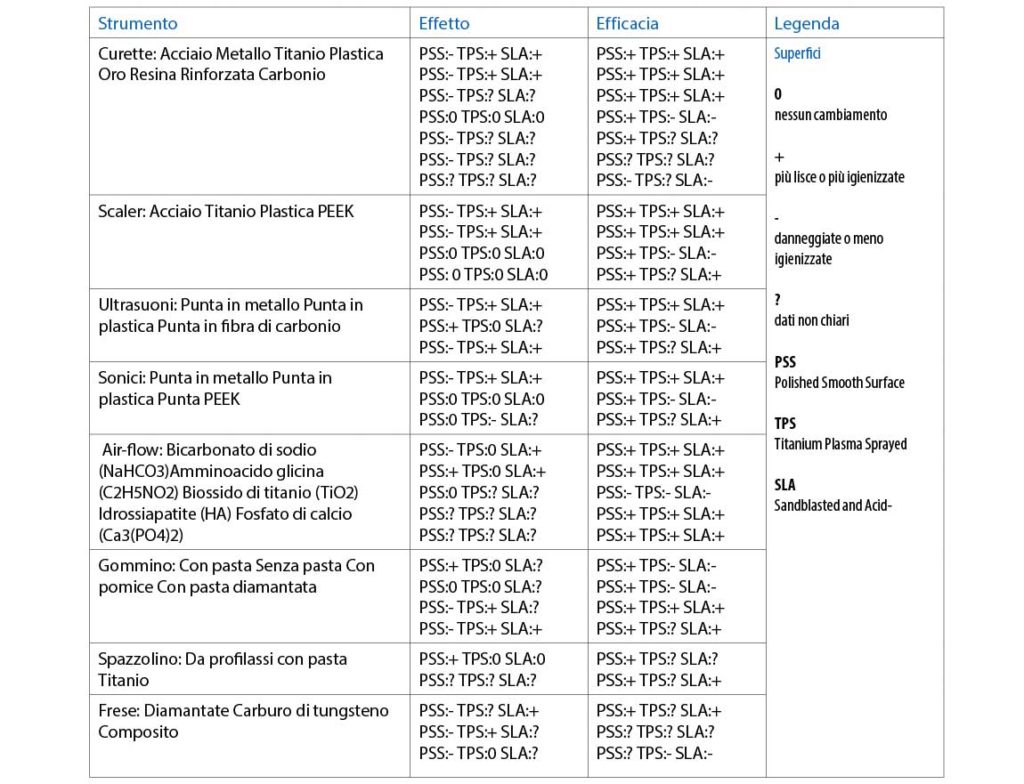
Discussione
In base alla presente revisione, il gommino con o senza pasta e gli strumenti non metallici sembrano essere gli strumenti idonei per evitare o perlomeno limitare i danni su superfici PSS. Il gommino ha uguali effetti sulle superfici PSS con o senza pasta e, indipendentemente dalla granulometria utilizzata, rende le superfici PSS ancora più levigate e lisce (Homiak et al., 1992; McCollum et al., 1992).
E’ possibile rimuovere le più piccole alterazioni e ristabilire l’integrità superficiale alterata in seguito alla strumentazione professionale, con procedure di polishing usando gommini con pasta di pomice o agenti lucidanti (Kwan et al., 1990; Rapley et al., 1990; McCollum et al., 1992). Nonostante ciò, se utilizzati in un piano periodico di mantenimento implantoprotesico, potrebbero creare superfici più ruvide e quindi più ritentive per la placca batterica.
Curette e scaler non metallici (plastica, teflon, resina rinforzata, polietereterchetone) sono efficaci nella rimozione del biofilm batterico superficiale e del tartaro dalle superfici implantari lisce (PSS), ma non sono efficaci su quelle ruvide (SLA e TPS).
Da questa revisione risulta chiaro che gli strumenti non metallici sono i più sicuri nel mantenimento dell’integrità superficiale e non creano danni su qualsiasi superficie. Tuttavia diversi studi dimostrano che è molto difficile, se non impossibile, rimuovere con curette in plastica la placca dentale dalle profonde scanalature che si vengono a creare sulle superfici implantari, soprattutto dopo trattamento plasma-sprayed (TPS) (Schmage et al. 2012; Hasturk et al. 2013).
Molto efficaci, ma altamente lesivi sulle superfici implantari, sono gli strumenti in acciaio inox ed anche il titanio quando utilizzato su superfici rivestite. Questi strumenti sia manuali che ultrasonici non sono raccomandati nelle fasi di mantenimento implantare.
Molto studiato negli ultimi tempi è il sistema Air Polishing (AP) soprattutto per il mantenimento periodico delle superfici implantari grazie alla sua elevata capacità decontaminante. Tutte le polveri sembrano efficaci nella rimozione del biofilm, ma le più studiate sono il bicarbonato di sodio (NaHCO3) e l’aminoacido glicina (C2H5NO2): entrambe le polveri sono efficaci nella rimozione della placca e dei prodotti batterici sia su superfici PSS, sia su quelle TPS che SLA.
La tecnica AP non risulta causare significative alterazioni superficiali sulle PSS, anche se il bicarbonato risulta più abrasivo e in grado di creare alterazioni al titanio rispetto alla polvere di glicina. La glicina sembra essere più efficacie anche in termini di maggior rimozione batterica rispetto al bicarbonato di sodio. Emerge dalle conclusioni di diversi studi che sia l’efficacia che il danno superficiale rimangono legati alle variabili del sistema AP come: il flusso d’acqua, il tempo di esposizione, la grandezza e la durezza delle particelle di polvere, la pressione esercitata dall’aria e la distanza tra la superficie e il getto (Louropoulou et al., 2012).
Gli ultrasuoni con punta metallica e in materiale plastico sono efficaci nella rimozione del biofilm sia sulle superfici PSS sia su quelle SLA (Schwarz et al. 2005; Kawashima et al., 2007). Se da una parte sono efficaci nella rimozione della placca batterica, dall’altra sono tra gli strumenti meccanici che creano più danni superficiali, formando delle nicchie ritentive che aumentano la colonizzazione batterica sulla superficie dell’impianto(68).
Le punte ultrasoniche non metalliche sembrano essere efficaci nella rimozione solo di alcune specie batteriche del biofilm e solo su superfici PSS. Gli inserti in polietereterchetone (PEEK) data la loro resistenza e scarsa capacità di alterare le superfici, risultano essere strumenti validi per quanto riguarda l’efficacia e gli effetti clinici sulle superfici implantari.
Quadri di infiammazione e/o infezione dei tessuti perimplantari possono causare riassorbimento osseo e migrazione apicale del margine gengivale portando all’esposizione delle spire dell’impianto e quindi delle superfici ruvide che risultano estremamente ritentive per la colonizzazione batterica.
La decontaminazione di queste spire è indispensabile per il successo nel trattamento della perimplantite: lo scopo dei trattamenti è decontaminare la superficie in modo da ricreare e ristabilire un sigillo biologico, osseo e tissutale, tra l’impianto e il parodonto.
L’uso di strumenti metallici e frese diamantate o multilama rendono più lisce le superfici ruvide, ma sono raccomandati solo nei casi in cui è necessaria la rimozione e/o la rifinitura o lucidatura del rivestimento esterno implantare.
Gli spazzolini in titanio sembrano essere degli strumenti efficaci per la rimozione meccanica della placca, soprattutto su superfici SLA (Gustumhaugen et al., 2013)(69).
Conclusioni e implicazioni cliniche
Pur nei limiti del presente studio ci sentiamo di concludere che da questa revisione della letteratura è possibile stabilire un gold standard strumentale in base alle diverse situazioni con le quali il clinico si confronta nella sua pratica giornaliera.
Si conclude che in caso di salute tissutale, il professionista attuerà un piano di mantenimento atto a prevenire l’insorgenza di eventuali stati patologici al fine di mantenere la situazione fisiologica preesistente: strumenti non metallici (in plastica), punte PEEK, air-flow (glicina e bicarbonato di sodio) e gommino con o senza pasta per tutti i tipi di superfici (PSS, TPS e SLA) sono gli strumenti idonei a preservare la salute tissutale perimplantare e a evitare alterazioni superficiali potenzialmente fonte di ritenzione batterica.
In caso di infezione perimplantare (perimplantite) si dovrà compiere un intervento terapeutico personalizzato atto a creare una decontaminazione del sito. l’intervento per essere efficace dovrà essere eseguito con curette in acciaio e/o titanio, inserti sonici ed ultrasonici, frese diamantate e multilama, strumenti in grado di eliminare le ruvidità superficiali delle spire inquinate dai batteri e dai loro prodotti. Tutti questi strumenti sono intrinsecamente in grado di creare un “danno strutturale” all’impianto ma che allo stesso tempo si traduce in un effetto “danno/beneficio” in grado di favorire la decontaminazione perimplantare.
Non esiste, ad oggi, uno strumento adeguato ed ideale per tutte le superfici implantoprotesiche e per tutte le diverse situazioni cliniche e terapeutiche. Tutti gli strumenti possono essere di volta in volta utili o dannosi a seconda delle diverse contingenze operative: il professionista dovrà conoscerli approfonditamente e utilizzarli in modo appropriato, in quanto tutti i sussidi professionali sono potenzialmente in grado di creare alterazioni superficiali.
Per questo motivo, ogni qual volta il professionista si troverà a trattare una superficie implantare dovrà prima conoscerne:
• la misura del transmucoso e del collo implantare in millimetri, tramite radiografia endorale;
• la conformazione e le caratteristiche superficiali dell’abutment e dell’impianto, la morfologia macro- e microscopica del collo e delle spire implantari.
Ulteriori ricerche andranno condotte in futuro per approfondire l’argomento trattato e stabilire altre e più definitive implicazioni cliniche, preferibilmente tramite studi in vivo.
- Atieh MA, Alsabeeha NH, Faggion CM Jr, Duncan WJ. The frequency of peri-implant diseases: a systematic review and meta-analysis. J Periodontol 2013;84(11):1586-98.
- Esposito M, Grusovin MG, Tzanetea E, Piatelli A, Worthington HV. Interventions for replacing missing teeth: treatment of periimplantitis. Cochrane Database Syst Rev 2010;16:CD004970.
- Lindhe J, Meyle J. Peri-implant diseases: consensus report of the Sixth European Workshop on Periodontology. J Clin Periodontol 2008;35(Suppl.8):282–5.
- Schroeder A, Van der Zypen E, Stich H, Sutter F. The reactions of bone, connective tissue, and epithelium to endosteal implants with titanium-sprayed surfaces. J Maxillofac Surg 1981;9(1):15-25.
- Brough Muzzin KM, Jonson R, Carr P, Daffron P. The dental hygienist’s role in the maintenance of osseointegrated dental implants. J Dent Hyg 1988;62:448-53.
- Berglundh T, Lindhe J, Jonsson K, Ericsson I. The topography of the vascular systems in the periodontal and peri-implant tissues dog. J Clinical Periodontol 1994 Mar;21(3):189-93.
- Lindhe J, Thorkild K, Mauricio A, Wennstrom L, Berglundh T. In: Lindhe J, Lang NP, Karring T, editors. Mucosa gengivale e perimplantare. 5th ed. Milano: Edi-Ermes; 2010. p. 69-108.
- PRISMA Statement, Preferred Reporting Items for Systematic Reviews and Meta-Analyses. Available from: http://www.prisma-statement.org/ (accessed September 2009).
- Louropoulou A, Slot DE, Van der Weijden F. Titanium surface alterations following the use of different mechanical instruments: a systematic review. Clin Oral Implants Res 2012;23(6):643-58.
- Louropoulou A, Slot DE, Van der Weijden F. The effects of mechanical instruments on contaminated titanium dental implant surfaces: a systematic review. Clin Oral Implants Res 2014;25(10):1149-60.
- Thomson-Neal D, Evans GH, Meffert RM. Effects of various prophylactic treatments on titanium, sapphire and hydroxyapatite-coated implants: an SEM study. Int J Periodontics Restorative Dent 1989;9:300–11.
- Rapley JW, Swan RH, Hallmon WW, Mills MP. The surface characteristics produced by various oral hygiene instruments and materials on titanium implant abutments. Int J Oral Maxillofac Implants 1990;5:47–52.
- Fox SC, Moriarty JD, Kusy RP. The effects of scaling a titanium implant surface with metal and plastic instruments: an in vitro study. J Periodontol 1990;61:485–90.
- Kwan JY, Zablotsky MH, Meffert RM. Implant maintenance using a modified ultrasonic instrument. J Dent Hyg 1990;64:422-30.
- Barnes CM, Fleming LS, Mueninghoff LA. An SEM evaluation of the in-vitro effects of an air-abrasive system on various implant surfaces. Int J Oral Maxillofac Implants 1991;6:463–9.
- Gantes BG, Nilveus R. The effect of different hygiene instruments on titanium surfaces: SEM observations. Part 1: Effect size. Int J Periodontics Restorative Dent 1991;11:225–39.
- Koka S, Han JS, Razzoog ME, Bloem TJ. The effects of two-air powder abrasive prophylaxis systems on the surface of machined titanium: a pilot study. Implant Dent 1992;1:259–65.
- Homiak AW, Cook PA, DeBoer J. Effect of hygiene instrumentation on titanium abutments: a scanning electron microscopy study. J Prosthet Dent 1992;67:364–9.
- McCollum J, O’Neal RB, Brennan WA, Van Dyke TE, Horner JA. The effect of titanium implant abutment surface irregularities on plaque accumulation in vivo. J Periodontol 1992;63:802–5.
- Ruhling A, Kocher T, Kreusch J, Plagmann HC. Treatment of subgingival implant surfaces with Teflon-coated sonic and ultrasonic scalers tips and various implant curettes. An in vitro study. Clin Oral Implants Res 1994;5:19–29.
- Razzoog ME, Koka S. In vitro analysis of the effects of two air-abrasive prophylaxis systems and inlet air pressure on the surface of titanium abutment cylinders. J Prosthond 1994;3:103–7.
- Kuempel DR, Johnson GK, Zaharias RS, Keller JC. The effects of scaling procedures on epithelial cell growth on titanium surfaces. J Periodontol 1995;66:228–34.
- Hallmon WW, Waldrop TC, Meffert RM, Wade BW. A comparative study of the effects of metallic, nonmetallic and sonic instrumentation on titanium abutment surfaces. Int J Oral Maxillofac Implants 1996;11:96–100.
- Matarasso S, Quaremba G, Coraggio F, Vaia E, Cafiero C, Lang NP. Maintenance of implants: an in vitro study of titanium implant surface modifications subsequent to the application of different prophylaxis procedures. Clin Oral Implants Res 1996;7:64–72.
- Meschenmoser A, d’Hoedt B, Meyle J, Elbner G, Korn D, Hammerle H, Schulte W. Effects of various hygiene procedures on the surface characteristics of titanium abutments. J Periodontol 1996;67:229–35.
- Cross-Poline GN, Shaklee RL, Stach DJ. Effect of implant curettes on titanium implant surfaces. Am J Dent 1997;10:41–5.
- Brookshire FV, Nagy WW, Dhuru VB, Ziebert GJ, Chada S. The qualitative effects of various types of hygiene instrumentation on commercially pure titanium and titanium alloy implant abutments: an in vitro and scanning electron microscope study. J Prosthet Dent 1997;78:286–94.
- Mengel R, Buns CE, Mengel C, Flores-de-Jacoby L. An in vitro study of the treatment of implant surfaces with different instruments. Int J Oral Maxillofac Implants 1998;13:91–6.
- Mouhyi J, Sennerby L, Pireaux JJ, Dourov N, Nammour S, Van Reck, J. An XPS and SEM evaluation of six chemical and physical techniques for cleaning of contaminated titanium implants. Clin Oral Implants Res 1998;9:185–94.
- Bain CA. An in vitro and in vivo evaluation of various implant-cleaning instruments. Quintessence Int 1998;29:423–7.
- Augthun M, Tinschert J, Huber A. In vitro studies on the effect of cleaning methods on different implant surfaces. J Periodontol 1998;69:857–64. 32.
- Bailey GM, Gardner JS, Day MH, Kovanda BJ. Implant surface alterations from a nonmetallic ultrasonic tip. J West Soc Periodontol Periodontal Abstr 1998;46:69–73.
- Rimondini L, Cicognani R, Simoncini F, Carrassi A. Micro-morphometric assessment of titanium plasma-sprayed coating removal using burs for the treatment of peri-implant disease. Clin Oral Implants Res 2000;11:129–38.
- Ruhling A, Hellweg A, Kocher T, Plagmann HC. Removal of HA and TPS implant coatings and fibroblast attachment on exposed surfaces. Clin Oral Implants Res 2001;12:301–8.
- Matsuyama T, Aoki A, Ida S, Yoneyama T, Ishikawa I. Effects of the Er:YAG laser irradiation on titanium implant materials and contaminated implant abutment surfaces. J Clin Laser Med Surg 2003;21:7-17.
- Schwarz F, Rothamel D, Sculean A, Georg T, Scherbaum W, Becker J. Effects of an Er:YAG laser and the Vector ultrasonic system on the biocompatibility of titanium implants in cultures of human osteoblast-like cells. Clin Oral Implants Res 2003;14:784–92.
- Mengel R, Meer C, Flores-de-Jacoby L. The treatment of uncoated and titanium nitride-coated abutments with different instruments. Int J Oral Maxillofac Implants 2004;19:232–8.
- Sato S, Kishida M, Ito K. The comparative effect of ultrasonic scalers on titanium surfaces: an in vitro study. J Periodontol 2004;75:1269–73.
- Kreisler M, Kohnen W, Christoffers AB, Gotz H, Jansen B, Duschner H, d’Hoedt B. In vitro evaluation of the biocompatibility of contaminated implant surfaces treated with an Er:YAG laser and an air powder system. Clin Oral Implants Res 2005;16:36–43.
- Ramaglia L, Di Lauro AE, Morgese F, Squillace A. Profilometric and standard error of the mean analysis of rough implant surfaces treated with different instrumentations. Implant Dent 2006;15:77–82.
- Barbour ME, O’Sullivan DJ, Jenkinson HF, Jagger DC. The effects of polishing methods on surface morphology, roughness and bacterial colonization of titanium abutments. J Mater Sci Mater Med 2007;18:1439–47.
- Kawashima Z, Sato S, Kishida I, Yagi H, Matsumoto K. Treatment of titanium dental implants with three piezoelectric ultrasonic scalers: an in vivo study. Part 1: Peri-implant diseases and surface alterations. J Periodontol 2007;78:1689–94.
- Schwarz F, Ferrari D, Popovski K, Hartig B, Becker J. Influence of different air-abrasive powders on cell viability at biologically contaminated titanium dental implants surfaces. J Biomed Mater Res Part B: Applied Biomaterials 2009;88:91–9.
- Duarte PM, Reis AF, de Freitas PM, Ota-Tsuzuki C. Bacterial adhesion on smooth and rough titanium surfaces after treatment with different instruments. J Periodontol 2009;80:1824–32.
- Mann M, Parmar D, Walmsley AD, Lea SC. Effect of plastic-covered ultrasonic scalers on titanium implant surfaces. Clin Oral Implants Res 2012;23(1):76-82.
- Schmage P, Thielemann J, Nergiz I, Scorziello TM, Pfeiffer P. Effects of 10 cleaning instruments on four different implant surfaces. Part B: Cleaning instruments. Int J Oral Maxillofac Implants 2012;27(3):318–27.
- Unursaikhan O, Lee JS, Cha JK, Park JC, Jung UW, Kim CS, Cho KS, Choi SH. Comparative evaluation of rounghness of titanium surfaces treated by different hygiene instruments. J Periodontal Implant Sci 2012;42(3):88-94.
- Fakhraval B, Kholht A, Jefferies SR, Suzuki JB. Probing and scaling instrumentation on implant abutment surfaces: an in vitro study. Implant Dent 2012;21(4):311-6.
- Park JB, Kim N, Ko Y. Effects of ultrasonic scaler tips and toothbrush on titanium disc surfaces evaluated with confocal microscopy. J Craniofac Surg 2012;23(5):1552-8.
- Hasturk H, Nguyen DH, Sherzai H, Song X, Soukos N, Bidlack FB, Van Dyke TE. Comparison of the impact of scaler material composition on polished titanium implant abutment surfaces. J Dent Hyg 2013;87(4):200-11.
- Cochis A, Fini M, Carrassi A, Migliario M, Visai L, Rimondini L. Effect of air polishing with glycine powder on titanium abutment surfaces. Clin Oral Implants Res 2013;24(8):904-9.
- Parham PL, Jr Cobb CM, French AA, Love JW, Drisko CL, Killoy WJ. Effects of an air-powder abrasive system on plasma-sprayed titanium implant surfaces: an in vitro evaluation. J Oral Implantol 1989;15:78–86.
- Gantes BG, Nilveus R. The effects of different hygiene instruments on titanium surfaces: SEM observations. Part 2: Cleaning efficacy. Int J Periodontics Restorative Dent 1991;11:239–49.
- Zablotsky MH, Diedrich DL, Meffert RM. Detoxification of endotoxin-coated titanium and hydroxyapatite-coated surfaces utilizing various chemotherapeutic and mechanical modalities. Implant Dent 1992;1:154-8.
- Speelman JA, Collaert B, Klinge B. Evaluation of different methods to clean titanium abutments. A scanning electron microscopic study. Clin Oral Implants Res 1992;3:120–7.
- Dennison DK, Huerzeler MB, Quinones C, Caffesse RG. Contaminated implant surfaces: an in vitro comparison of implant surface coating and treatment modalities for decontamination. J Periodontol 1994;65:942–8.
- Pereira da Silva CH, Vidigal GM, Jr de Uzeda M, de Almeida Soares G. Influence of titanium surface roughness on attachment of Streptococcus sanguis: an in vitro study. Implant Dent 2005;14:88–93.
- Schwarz F, Sculean A, Romanos G, Herten M, Horn N, Scherbaum W, Becker J. Influence of different treatment approaches on the removal of early plaque biofilms and the viability of SAOS2 osteoblasts grown on titanium implants. Clin Oral Investig 2005;9:111–7.
- Kawashima Z, Sato S, Kishida I, Yagi Η, Matsumoto Κ. Treatment of titanium dental implants with three piezoelectric ultrasonic scalers: an in vivo study. Part 2: Ultrasonic scalers. J Periodontol 2007;78:1694–713.
- Schwarz F, Ferrari D, Popovski K, Hartig B, Becker J. Influence of different air-abrasive powders on cell viability at biologically contaminated titanium dental implants surfaces. J Biomed Mater Res Part A: Applied Biomaterials 2009;88:83–91.
- Schmage P, Thielemann J, Nergiz I, Scorziello TM, Pfeiffer P. Effects of 10 cleaning instruments on four different implant surfaces. Part A: Cleaning efficacy. Int J Oral Maxillofac Implants 2012;27(2):308-17.
- Tastepe CS, van Waas R, Liu Y, Wismeijer D. Air powder abrasive treatment as an implant surface cleaning method: a literature review. Int J Oral Maxillofac Implants 2012;27:1461–73.
- Nemer Vieira LF, Lopes de Chaves Mello Dias EC, Cardoso ES, Machado SJ, da Silva CP, Vidigal GM. Effectiveness of implant surface decontamination using a high-pressure sodium bicarbonate protocol: an in vitro study. Implant Dent 2012;21:390–3.
- Idlibi AN, Al-Marrawi F, Hannig M, Lehmann A, Rueppell A, Schindler A, Jentsch H, Rupf S. Destruction of oral biofilm formed in situ on machined titanium (Ti) surfaces by cold atmospheric plasma. Biofouling 2013;29:369–79.
- John G, Becker J, Schwarz F. Rotating titanium brush for plaque removal from rough titanium surfaces-an in vitro study. Clin Oral Implants Res 2014;25(7):838-42.
- Park JB, Jang YJ, Koh M, ChoiBK, Kim KK, Ko Y. In vitro analysis of the efficacy of ultrasonic scalers and toothbrush for removing bacteria from resorbable blast material titanium disks. J Periodontol 2013;84(8):1191-8.
- Marconcini S, Genovesi AM, Marchisio O, Gelpi F, Barone A, Corega C, Bertossi D, Pardo A, Nocini PF, Rigoni G, De Santis D, Covani U. In vivo study of titanium healing screws surface modifications after different debridement procedure. Minerva Stomatol [Internet]. 2014. EPub 2014 Jan 14.Available from Minerva Stomatologica: http://www.minervamedica.it/it/riviste/minerva-stomatologica/articolo.php?cod=R18Y9999N00A140030
- Lang NP, Lindhe J. Maintenance of the implant patient. In: Lindhe J, Karring T, Lang NP, editors. Clinical Periodontology and Implant Dentistry. 4th ed. Copenhagen: Blackwell Munksgaard;2003.p.1024.
- Gustumhaugen E, Leonn-Stensrud J, Scheie AA, Lyngstadaas SP, Ekfeldt A, Taxt-Lamolle S. Effect of chemical and mechanical debridement techniques on bacterial re-growth on rough titanium surfaces: an in vitro study. Clin Oral Implants Res 2014;25(6):707-13.