L’erosione dentale è la perdita progressiva della superficie dentaria in conseguenza alla continua esposizione del dente a sostanze acide. Obiettivo del presente lavoro è verificare la correlazione tra nuoto a livello agonistico in piscina ed erosione dentale.
Come fattore protettivo è risultato significativo l’utilizzo di un dentifricio senza particolari proprietà. Non sono state rilevate correlazioni statisticamente significative tra la presenza di erosioni e le variabili riguardanti l’alimentazione. Quando i possibili fattori di rischio sono valutati in maniera dipendente l’uno dall’altro, è risultata un’associazione tra erosione ed età, ovvero un nuotatore di 25 anni (o più) ha un rischio 10 volte superiore rispetto a un nuotatore di 14-17 anni di sviluppare
INTRODUZIONE
L’erosione dentale viene definita come una perdita progressiva della superficie dentaria in conseguenza di un processo chimico. È infatti provocata dalla continua esposizione del dente a sostanze acide di origine estrinseca o intrinseca (1,2).
La sua prevalenza è in continuo aumento negli ultimi anni, specialmente nelle fasce di età più giovani (bambini e adolescenti), probabilmente a causa di un cambiamento degli stile di vita e della nutrizione (3).
La diagnosi di erosione si basa sulla valutazione e classificazione dei segni clinici presenti e un’accurata anamnesi generale del paziente. Quest’ultima deve includere la storia medica, abitudini alimentari e dentali (per esempio bruxismo), malattie generali, i farmaci, la storia sociale (fattori occupazionali, hobby eccetera) (4).
Invece, nella parte clinica vengono utilizzati indici di usura, che si basano sull’osservazione e valutazione dei cambiamenti anatomici delle superfici dentali. A tal fine viene assegnato un punteggio in base ad alcuni fattori (severità, estensione, localizzazione eccetera).
Generalmente viene utilizzato il Basic Erosive Wear Examination (BEWE) (5), dove vengono esaminate tutte le superfici dentali (buccali/facciali, occlusali e linguali/palatali) di ogni dente (esclusi i terzi molari) e a ogni superficie di ciascun elemento dentario viene dato un punteggio da 0 a 3. Il valore 0 corrisponde a nessuna perdita superficiale, il valore 1 a una iniziale perdita della superficie dello smalto, il valore 2 a una perdita minore del 50% di tessuto duro della superficie, il valore 3 a una perdita superiore al 50% di tessuto duro della superficie del dente.
Per ogni sestante viene registrata solo la superficie con il punteggio più alto. Una volta valutati tutti i sestanti, viene calcolata la somma dei punteggi (Tab. 1).

In base al punteggio ottenuto si definisce un determinato livello di rischio e la relativa gestione clinica consigliata (Tab. 2).

L’erosione ha una eziologia multifattoriale, quindi è molto importante identificare tutti i fattori causali rilevanti, affinché la progressione cessi. I fattori si possono dividere in estrinseci (cibi e bevande acide eccetera) e intriseci (reflusso gastrico, vomito eccetera), che possono agire separatamente o contemporaneamente (6).
Esiste un ampia letteratura scientifica sull’erosione nei bambini e adolescenti (7). Gli studi su bambini con dentizione decidua hanno mostrato un ampio range che può variare dal 6% al 70,6%-78% (8-11). Negli adolescenti con dentizione permanente la prevalenza dell’erosione può variare dal 7,6% fino anche al 100% (12-13), con una media del 30,4% tra gli 8 e i 19 anni (14). La prevalenza di erosione nella fascia di età adulta della popolazione varia da un minimo del 4% tra i 26-55 anni (15) e un massimo di 97,9% (16).
La distribuzione delle erosioni ha mostrato una predominanza nelle superfici occlusali (soprattutto primi molari mandibolari) seguite da quelle vestibolari (soprattutto dei denti mascellari anteriori) (17). Le possibili fonti estrinseche degli acidi sono la dieta, farmaci, stile di vita, fattori occupazionali e comportamentali (18). La più importante tra queste è la dieta, che include numerosi componenti e prodotti con composizione complessa e diverso potenziale erosivo (19). Il potenziale erosivo di una bevanda acida non dipende esclusivamente dal suo pH, ma è anche fortemente influenzato da altri fattori come la capacità tampone o l’acidità titolabile. Quest’ultima è espressa come la quantità di acido\base necessaria ad aumentare/abbassare il pH al valore 7.0, mentre la capacità tampone della bevanda influenza il processo di neutralizzazione da parte della saliva e la durata del processo erosivo (20,21). Maggiore è la capacità tampone della bevanda o del cibo, più tempo la saliva impiegherà a neutralizzare l’acido e questo influenzerà in modo significativo l’erosione, perché più a lungo i denti si trovano in un ambiente acido senza l’effetto protettivo della saliva e maggiore sarà il processo di demineralizzazione (22). Vi sono poi fattori che riducono il potenziale erosivo, proteggendo il dente, come per esempio l’assunzione di sali di calcio e fosfato nelle bevande con basso pH e un elevato consumo di yogurt e latte (20,23).
In numerosi studi è stato dimostrato che l’assunzione di soft drink (per esempio cole) e succhi di frutta porta un elevato rischio di sviluppare erosione dentale nei bambini e negli adolescenti (14,24,25). Il consumo eccessivo di frutta acida come le arance è anch’esso correlato all’erosione dentale, mentre il consumo eccessivo di caramelle acide, combinato con una bassa capacità di tamponamento salivare, è strettamente legato all’aggravamento delle lesioni erosive (26,27). Altri aspetti da tenere in considerazione sono il quando e il come vengono consumati tali cibi o bevande. I metodi di assunzione che favoriscono il rischio di erosione sono il risciacquare o sorseggiare per 15 minuti una bevanda acida, perché queste azioni causano un abbassamento del pH all’interno del cavo orale per un lungo periodo di tempo, mentre il metodo che causa un abbassamento drastico del pH è il mantenere in bocca 10 ml di bevanda acida per 2 minuti (28,29,30,31). L’alta frequenza di assunzione di frutta o succhi di frutta può essere potenzialmente dannosa, in particolare i succhi di origine citrica hanno una elevata capacita tampone e sono in grado di mantenere un ambiente acido nel cavo orale per un lungo periodo (20).
L’erosione dentale (19) può essere collegata anche al consumo di droghe sintetiche, come l’ecstasy (32), o l’abuso di alcol (33). I farmaci sono un altro fattore di rischio molto rilevante per l’erosione dentale, perché contengono molecole acide necessarie per la distribuzione del principio attivo; inoltre può esserci la presenza dello zucchero per migliorare il gusto (34).
Alcuni farmaci, come per esempio sedativi, antistaminici, antiemetici e antiparkinsoniani possono aumentare il rischio di erosione in quanto possono ridurre il flusso salivare e/o la capacità tampone della saliva (35,36). L’erosione causata da fattori intriseci è il risultato di acidi endogeni, ovvero sostanze provenienti dal nostro organismo (37), in particolare il succo gastrico dello stomaco, che può risalire nel cavo orale ed entrare in contatto con i denti, attraverso episodi di reflusso, vomito e rigurgito.
Il contenuto gastrico viene reso acido dalla presenza dell’acido cloridrico, prodotto dalle cellule parietali dello stomaco, che può raggiungere un pH intorno al 1-1.5 (38). Vi è poi un aumentato rischio di erosione in persone che soffrono di disturbi alimentari, alcolismo cronico, malattia da reflusso gastroesofageo (GERD) e donne in gravidanza (37,39). Nelle persone che soffrono di disturbi alimentari di origine psicosomatica, come per esempio vomito nervoso, anoressia nervosa o bulimia, sono molto frequenti le erosioni causate da rigurgito o vomito autoindotto (37,40).
Frequentemente gli sportivi (nuotatori, pallanuotisti, atleti eccetera), per recuperare i liquidi persi durante l’allenamento, assumono bevande spesso acide, che, durante il periodo di diminuzione del flusso salivare, possono rappresentare un elevato rischio di malattie a livello del cavo orale (41). Inoltre, quelli che trascorrono molto tempo nell’acqua della piscina come i nuotatori, i giocatori di pallanuoto e i subacquei, sono esposti a un alto rischio di sviluppare l’erosione a causa dei composti del cloro utilizzati per la disinfezione delle acque delle piscine (42). La clorazione è il metodo di disinfezione più diffusamente utilizzato per l’inattivazione dei microrganismi patogeni nelle piscine, in cui vengono adoperati generalmente gas cloro, ipocloriti (di sodio, calcio o litio), ma anche isocianuri clorati (43).
La disinfezione dell’acqua della piscina è essenziale per la sicurezza igienica e la protezione dei bagnanti dalle malattie infettive causate da microrganismi patogeni (44,45). Se una piscina non viene adeguatamente controllata e tamponata, il pH può diminuire rapidamente e causare irritazione agli occhi, mucose, otite esterna acuta e problemi respiratori (per esempio asma) (46,47,48). Dalla letteratura disponibile sull’argomento, pur essendo relativamente limitata (49-58), si può evincere che i nuotatori a livello agonistico possono rappresentare un gruppo ad alto rischio per lo sviluppo di erosioni dentali, legato principalmente all’abbassamento del pH in piscine gas clorate non mantenute in modo adeguato, rispetto, per esempio, alle piscine che utilizzano l’ipoclorito di sodio come metodo di disinfezione.
Tuttavia, bisogna prestare attenzione anche alle piscine correttamente mantenute, perché l’abbassamento del pH non è il solo responsabile di possibili danni alle superfici dentarie. La sottosaturazione dell’acqua e i possibili cambiamenti a livello salivare (portata salivare, concentrazione di minerali contenenti nella saliva) possono favorire il processo di dissoluzione dell’idrossiapatite a causa della lunga esposizione dell’ambiente orale all’acqua della piscina, favorendo cosi nel tempo il possibile sviluppo di erosioni.
Altri possibili fattori di rischio sono l’età del soggetto, la durata dell’allenamento e gli anni di nuoto a livello agonistico, però non in tutti gli studi questi fattori sono risultati statisticamente significativi.
Obiettivo del presente lavoro è verificare la correlazione tra nuoto a livello agonistico in piscina ed erosione dentale. A tal fine è stato somministrato un questionario online a persone che hanno praticato o praticano nuoto a livello agonistico per valutare la presenza di erosione dentale riferita dal loro dentista e analizzare la correlazione tra erosione dentale e diversi possibili fattori di rischio (età, ore di allenamento, anni di allenamento, alimentazione prima/durante/dopo l’allenamento).
MATERIALI E METODI
Somministrazione del questionario
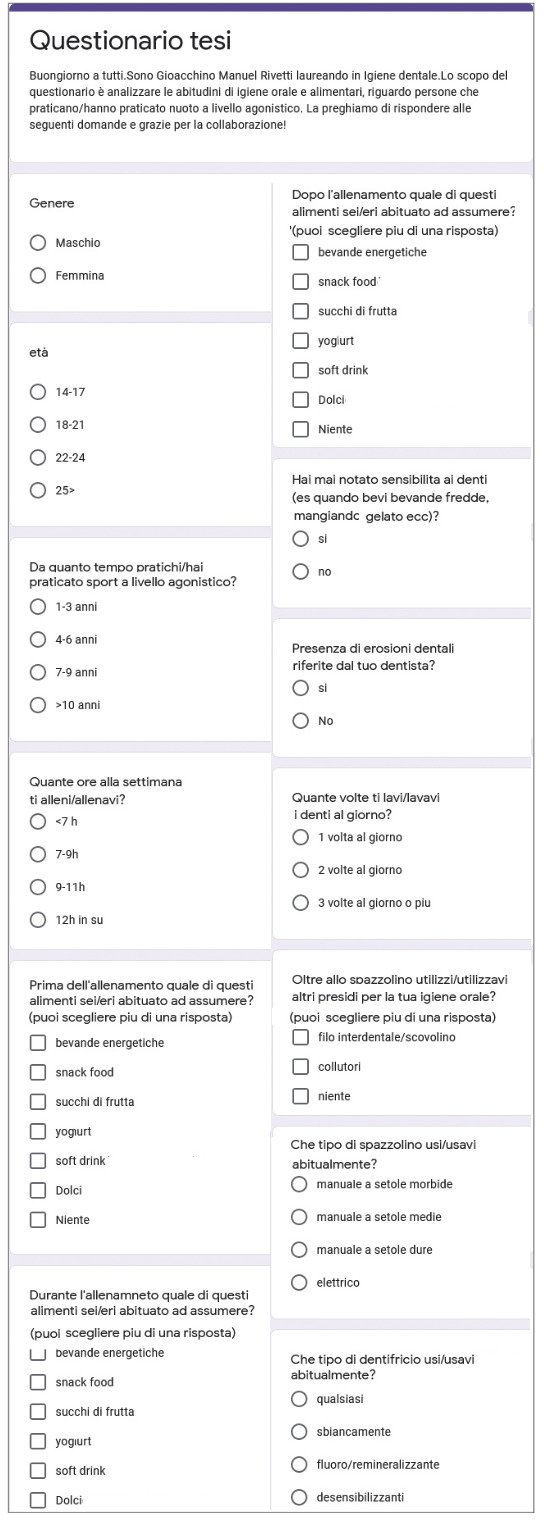
Per lo studio sono stati identificati soggetti di età uguale o superiore a 14 anni che praticano, o hanno praticato fino a tempi recenti, nuoto a livello agonistico, ai quali è stato somministrato, tramite applicazione web (Google Moduli), un questionario atto a valutare la presenza di erosione dentale riferita dal proprio dentista e ad analizzare l’eventuale correlazione con possibili indicatori di rischio, quali età, genere, ore di allenamento, anni di allenamento, alimentazione prima/durante/dopo l’allenamento, tempo trascorso tra l’assunzione di determinati cibi e l’igiene orale, tipo di spazzolino utilizzato, utilizzo del collutorio e/o filo interdentale/scovolino, tipo di dentifricio utilizzato, frequenza di spazzolamento, presenza di sensibilità dentinale.
Il campione di nuotatori è stato arruolato in parte attraverso le conoscenze degli autori e in parte selezionando in maniera casuale i partecipanti a gare agonistiche presenti sul sito della Federazione Italiana Nuoto (FIN). Il questionario è stato mandato ai selezionati tramite e-mail o messaggistica utilizzando l’apposito link.
Il questionario (Fig. 1) comprende domande su caratteristichedemografiche (sesso, fascia di età), storia sportiva (numero di ore e anni di allenamento a livello agonistico), abitudini di igiene orale domiciliare e alimentari durante il periodo di allenamento agonistico.
I risultati ottenuti sono stati analizzati una prima volta direttamente dall’applicazione web utilizzata per creare il questionario e una seconda volta dagli autori per essere certi della validità e accettabilità delle risposte, escludendo dall’analisi i questionari incompleti. I dati sono stati, poi, elaborati su foglio di calcolo Excel. Per l’analisi statistica dei dati è stato utilizzato un software specifico (Stata IC 15). Il disegno di studio utilizzato è un disegno di tipo trasversale analitico basato su questionari strutturati attraverso Google Moduli.
Analisi statistica
Statistica descrittiva
Le risposte sono state categorizzate in forma binaria nelle domande riguardanti le abitudini alimentari (prima, durante, dopo l’allenamento) e nella domanda riguardante l’utilizzo di presidi aggiuntivi oltre allo spazzolino. Le variabili dicotomiche e categoriche sono espresse come frequenza delle varie categori
e e dei loro intervalli di confidenza (IC 95%).
Statistica inferenziale
Le variabili inerenti alle abitudini di igiene orale, l’alimentazione (prima, durante e dopo l’allenamento), storia sportiva e domande generiche sono associate e analizzate con la presenza o assenza di erosione, espresse sotto forma di POR (prevalence odds ratio) e intervallo di confidenza (IC 95%). La significatività statistica è stata valutata con il test del χ2.
Per rispondere al secondo obiettivo è stato costruito un modello di regressione con tutte le variabili con la finalità di costruire un modello predittivo che, in base agli indicatori di rischio rilevati in maniera demoscopica nella coorte dei nuotatori, possa prevedere per la presenza di erosione.
RISULTATI
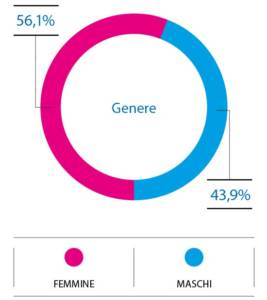
Hanno partecipato e compilato il questionario 180 partecipanti, per un totale di 180 questionari, di cui 7 non sono stati considerati perché non compilati correttamente. I questionari accettati, pertanto, sono stati 173. Hanno partecipato 97 femmine e 76 maschi (Fig. 2).
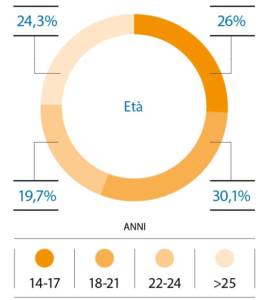
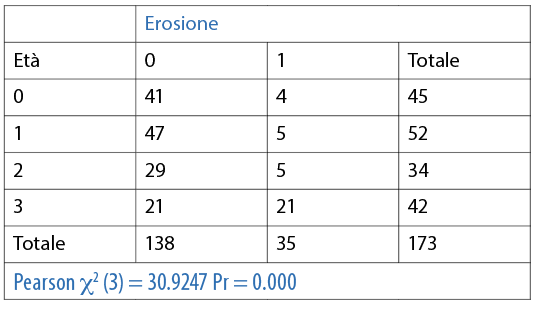
Il questionario prevedeva, inoltre, la suddivisione dei soggetti in quattro fasce di età: 14-17 anni (45 soggetti), 18-21 anni (52 soggetti), 22-24 anni (34 soggetti) e oltre 25 anni (42 soggetti) (Fig. 3).
Storia sportiva
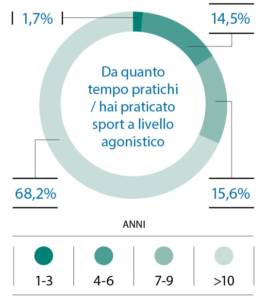
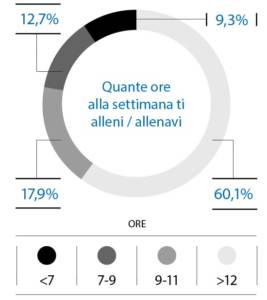
I partecipanti inclusi praticano sport a livello agonistico nel 68,2% da più di 10 anni e con più di 12 oredi allenamento a settimana (60,1%) (Fig. 4, 5).
L’alimentazione sportiva
Prima dell’allenamento soltanto il 35,3% deli soggetti non assume nulla, il restante 64,7% assume uno o più alimenti (Fig. 6), distribuiti nel modo seguente.
-
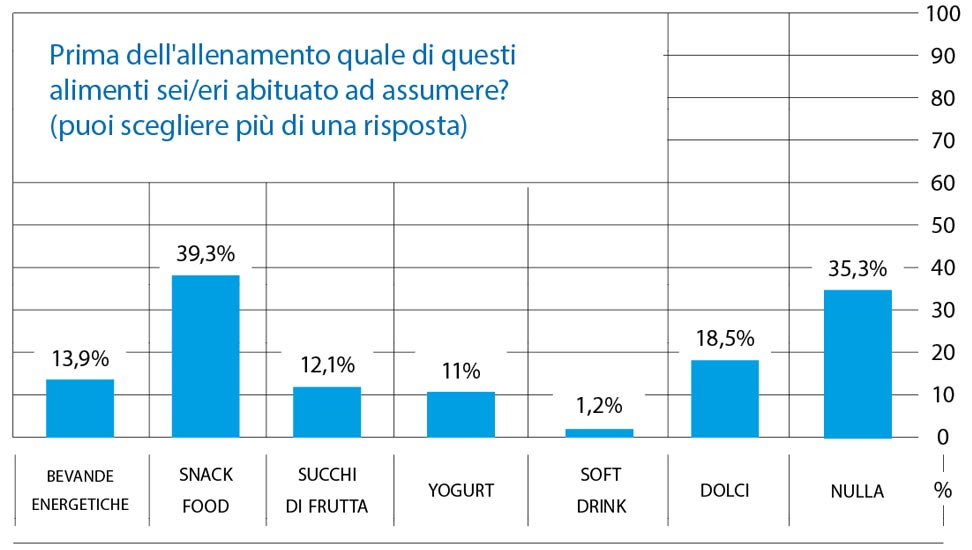
Fig. 6 Bevande energetiche 13,9%.
- Snack food (pizzette, tramezzini, barrette energetiche) 39,3%.
- Succhi di frutta 12,1%.
- Yogurt 11%.
- Soft drink (cola, aranciata, limonata, gassosa) 1,2%.
- Dolci (fette di torta, biscotti) 18,5%.
Durante l’allenamento il 60,1% preferisce evitare di assumere alimenti, il restante 39,9%, invece, assume uno o più dei seguenti alimenti (Fig. 7).
-
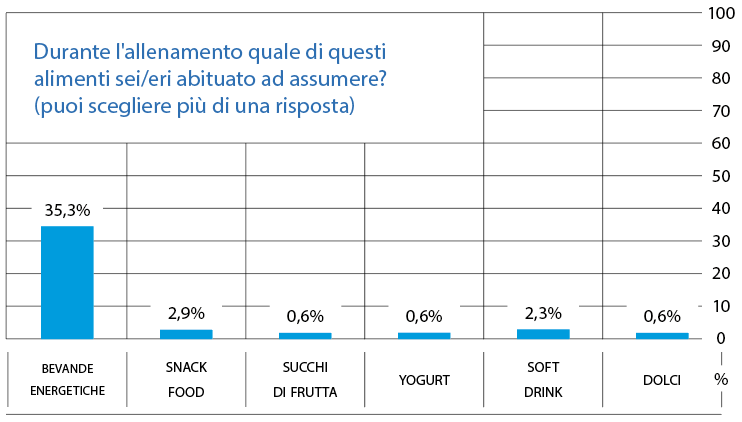
FIG. 7 Il 60,1% degli intervistati non assume cibo né bevande. Bevande energetiche 35,3%
- Snack food (pizzette, tramezzini, barrette energetiche) 2,9%
- Succhi di frutta 0,6%
- Yoghurt 0,6%
- Soft drink (cola, aranciata, limonata, gassosa) 2,3%
- Dolci (fette di torta, biscotti) 0,6%
Dopo l’allenamento il 21,4% non assume niente, il restante 79,6%, invece, assume uno o più alimenti (Fig. 8).
-
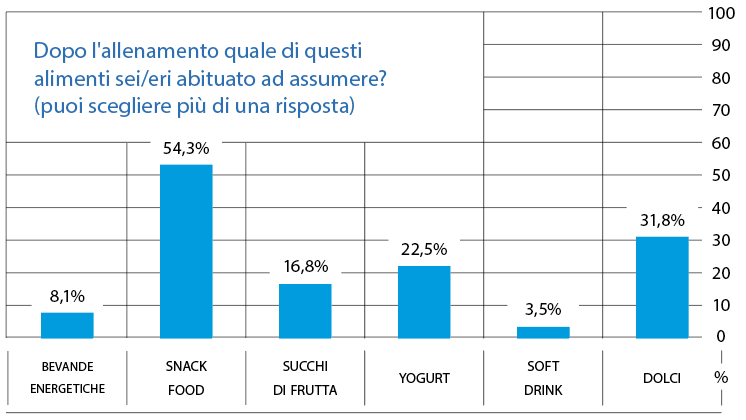
FIG. 8 Il 21,4% degli intervistati non assume cibo né bevande. Bevande energetiche 8,1%.
- Snack food (pizzette, tramezzini, barrette energetiche) 54,3%.
- Succhi di frutta 16,8%.
- Yogurt 22,5%.
- Soft drink (cola, aranciata, limonata, gassosa) 3,5%.
- Dolci (fette di torta, biscotti) 31,8%.
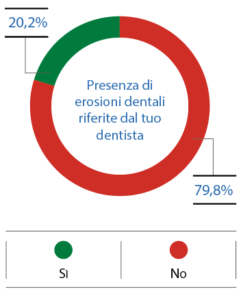
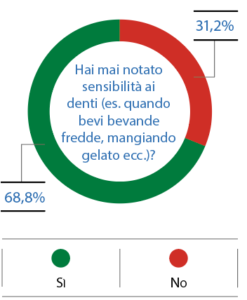
La prevalenza di erosione è stata rilevata dal proprio dentista nel 20,2% dei nuotatori (Fig. 9). La sensibilità dentinale è stata notata, invece, dal 68,8% dei partecipanti (Fig. 10).
Controllo biofilm domiciliare
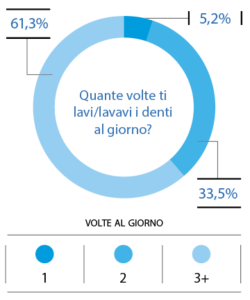
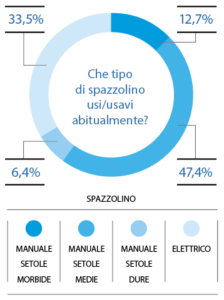
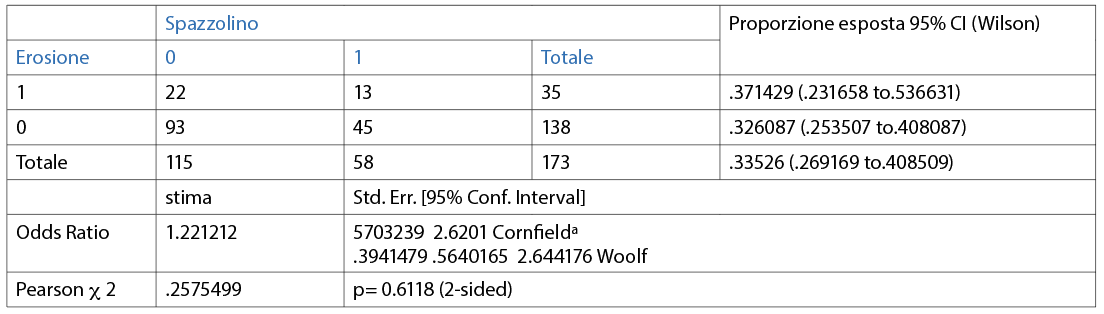
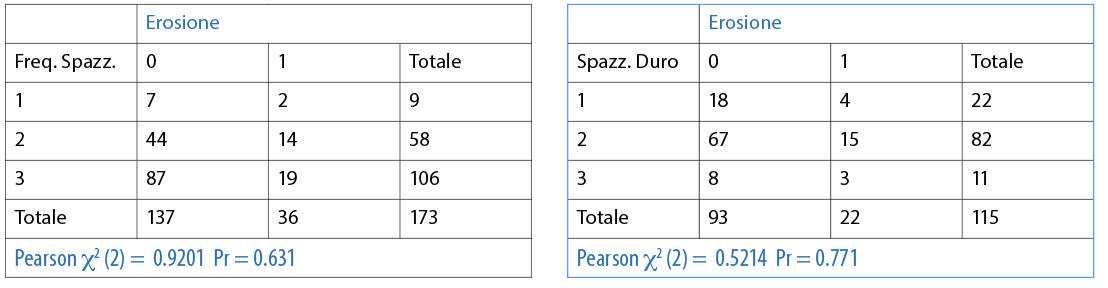
La maggioranza del campione afferma di spazzolarsi i denti tre volte al giorno (61,3%); il 33,5% afferma di spazzolarli 2 volte al giorno e il 5,2% afferma di lavarli 1 volta al giorno (Fig. 11). Il 47,4% dei partecipanti utilizza uno spazzolino manuale a setole medie; il 33,5% impiega lo spazzolino elettrico; il 12,7% utilizza uno spazzolino manuale a setole morbide e il 6,4% afferma di utilizzare uno spazzolino manuale a setole dure (Fig. 12).
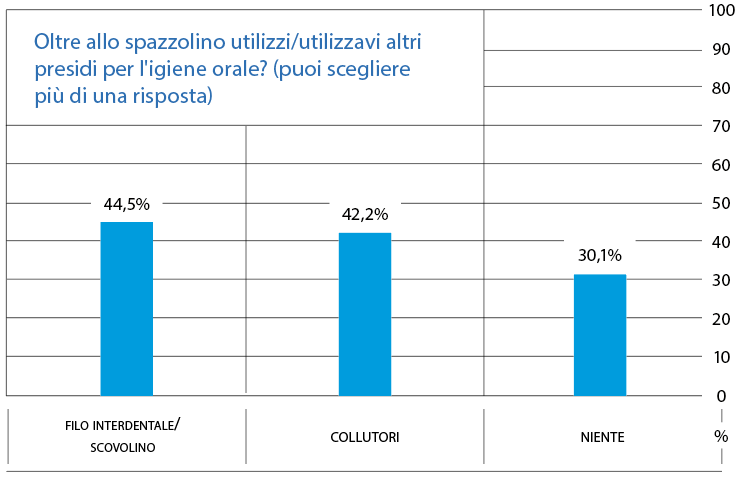
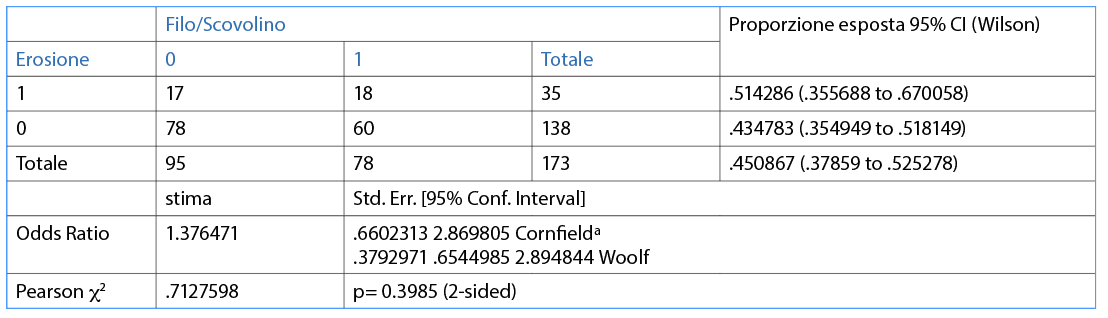
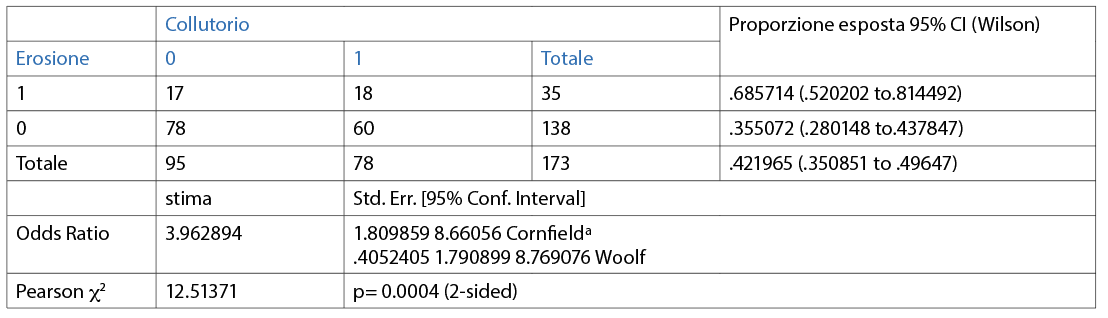
Il 30,1% dei partecipanti non utilizza alcun presidio meccanico aggiuntivo oltre allo spazzolino; più della metà dei partecipanti (69,9%) utilizza presidi aggiuntivi come, per esempio, il filo interdentale/scovolino (44,5%) e il collutorio (42,2%) (Fig. 13).
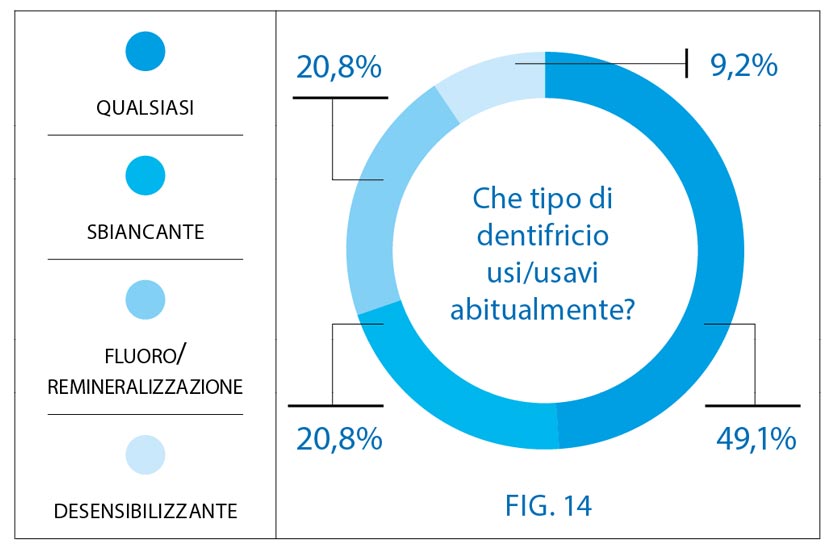
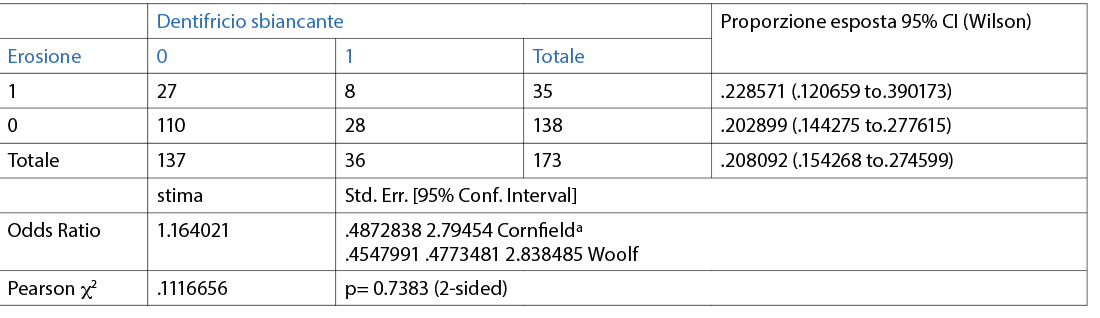
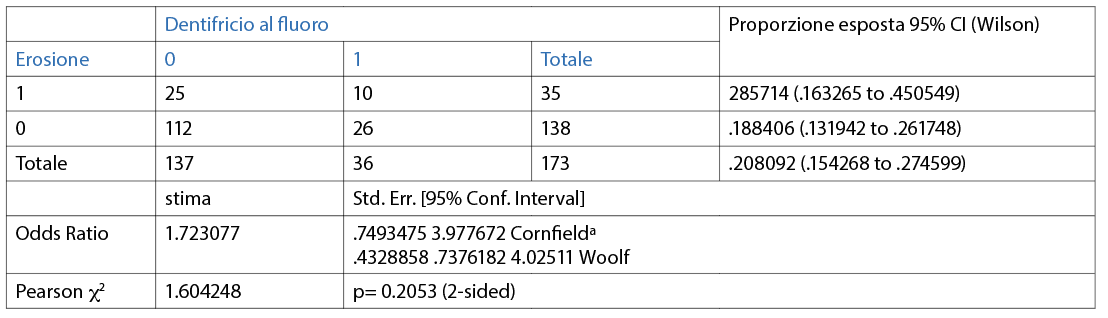
Quasi la metà dei partecipanti utilizza un dentifricio senza particolari proprietà (49,1%); il 20,8% afferma di utilizzare un dentifricio sbiancante; un altro 20,8%, invece, afferma di usare un dentifricio al fluoro/remineralizzante; solo il 9,2% riferisce di utilizzare un dentifricio desensibilizzante (Fig. 14).
Più della metà dei partecipanti si lava i denti mezz’ora dopo aver mangiato gli alimenti citati in precedenza (52,6%); il 16,2% lava i denti subito dopo averli mangiati e il 31,2% afferma di non lavarli proprio (Fig. 15).

Associazione con l’erosione
È stata valuta l’associazione tra l’erosione e le differenti variabili (dicotomiche o categoriche) in maniera individuale. Le abitudini di igiene orale domiciliare sono riporttqe nelle Tabelle 3, 4, 5, 6, 7, 8, 9 10. Inoltre, dai dati analizzati, è emerso che un dentifricio senza particolari proprietà è statisticamente significativo come fattore protettivo (odds ratio=0.4 circa e un p=0.0190) nei confronti dell’erosione. L’associazione è stata trovata tra erosione e l’età della persona (pr=0.000). La presenza di erosioni aumenta nel momento in cui la categoria aumenta di età (Tab 14-16).

Modello di regressione logistica multivariata
Le variabili sono state valutate in maniera dipendente l’una dall’altra e messe in associazione con l’erosione attraverso il modello di regressione logistica multivariata. È risultato che la presenza di erosione può essere spiegata da quattro variabili (Q1, età, durante l’allenamento, spazzolino). Se tale modello di regressione, che spiega il 20,2% delle erosioni riferite nel questionario, venisse considerato come mezzo diagnostico, avrebbe una sensibilità del 63,6%, una specificità dell’84,3% e un’area under the curve (AUC) di 0,76. All’interno di questo modello di regressione logistica multivariata risulta statisticamente significativo l’età del nuotatore, in quanto un nuotatore di 25 anni o più ha un odds ratio pari a 10 rispetto a un nuotatore di 14-17 anni (Tab. 12).
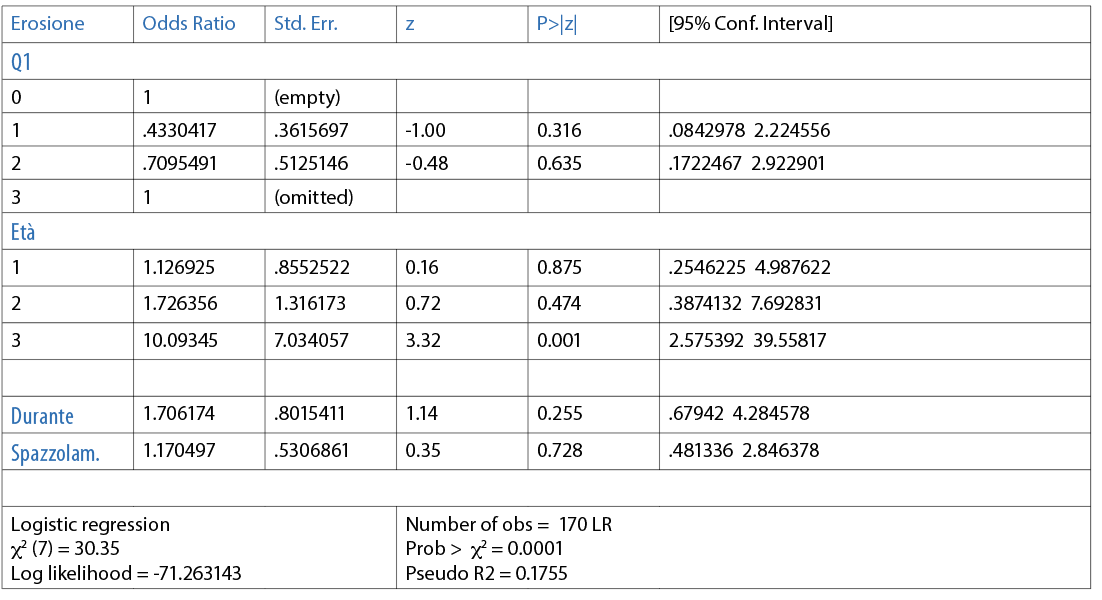
Discussione e conclusione
Dai risultati statistici è emerso che come fattore protettivo è significativo l’utilizzo di un dentifricio senza particolari proprietà. Non sono state trovare correlazioni statisticamente significative tra la presenza di erosioni e le variabili riguardanti l’alimentazione. Invece, quando i possibili fattori di rischio sono valutati in maniera dipendente l’uno dall’altro, è stata trovata un’associazione tra erosione ed età con una odds ratio di 10, ovvero un nuotatore di 25 anni (o più) ha la possibilità di sviluppare l’erosione in maniera 10 volte superiore rispetto a un nuotatore di 14-17 anni. La valutazione di questi fattori potrebbe essere inserita in aggiunta alla normale diagnosi di erosione nei nuotatori da parte degli odontoiatri. A ogni modo, per gli igienisti dentali, la prevenzione rimane sempre l’arma più importante per contrastare lo sviluppo di erosioni e ciò deve essere fatto sia a livello professionale, attraverso sedute di igiene orale e di fluoroprofilassi (vernici), sia a livello domiciliare tramite l’utilizzo di prodotti specifici come, per esempio, collutori remineralizzanti, dentifrici fluoro/remineralizzanti e, infine, mediante l’utilizzo di spray mucoadesivi prima dell’esercizio fisico, che potrebbero rappresentare un buon ausilio per il mantenimento del pH orale ideale durante l’allenamento. Nonostante la rilevanza presentata dai risultati ottenuti, è doveroso sottolineare che la popolazione presa come riferimento sia piuttosto ristretta e, inoltre, non è stato possibile valutare direttamente la presenza di erosioni, e quindi, i dati riferiti nel questionario potrebbero differire, anche in maniera significativa, dalla realtà. Sono pertanto auspicabili ulteriori studi du un campione rappresentativo della popolazione e un’analisi diretta del cavo orale dei soggetti.
Ganns C. Definition of erosion and links to tooth wear. Monogr Oral Sci 2006; 20:9-16.
W.H.O. Guidelines Approved by the Guidelines Review Committee. Guideline: Sugars Intake for Adults and Children. Geneva: World Health Organization; 2015.
Lussi A. Erosive tooth wear – A multifactorial condition of growing concern and increasing knowledge. Monogr Oral Sci 2006; 20:1-8.
Paryag A, Rafeek R. Dental erosion and medical conditions: An overview of aetiology, diagnosis and management. West Indian Med J 2014;63.
Bartlett D, Ganss C, Lussi A. Basic Erosive Wear Examination (BEWE): a new scoring system for scientific and clinical needs. Clin Oral Investig 2008 Mar;12(Suppl 1):S65-8.
Carvalho TS, Colon P, Ganss C, Huysmans MC, Lussi A, Schlueter N, Schmalz G. Consensus report of the European Federation of Conservative Dentistry: erosive tooth wear diagnosis and management. Swiss Dent J 2016;126:342–346.
Jaeggi T, Lussi A. Prevalence, incidence and distribution of erosion. Monogr Oral Sci 2006;20: 44–65.
Luo Y, Zeng XJ, Du MQ, Bedi R. The prevalence of dental erosion in preschool children in China. J Dent 2005;33:115–121.
Wiegand A, Müller J, Werner C, Attin T. Prevalence of erosive tooth wear and associated risk factors in 2-7-year-old German kindergarten children. Oral Disease 2006;12(2):117-24.
Ganss C, Klimek J, Giese K. Dental erosion in children and adolescents: a cross-sectional and longitudinal investigation using study models. Community Dent Oral Epidemiol 2001;29:264–271.
Kazoullis S, Seow WK, Holcombe T, Newman B, Ford D. Common dental conditions associated with dental erosion in schoolchildren in Australia. Pediatr Dent 2007;29:33–39.
Mangueira DF, Sampaio FC, Oliveira AF. Association between socioeconomic factors and dental erosion in Brazilian school-children. J Public Health Dent 2009;69:254–259.
l-Dlaigan YH, Shaw L, Smith A. Dental erosion in a group of British 14-year-old, school children. I. Prevalence and influence of differing socioeconomic backgrounds. Br Dent J 2001;190:145–149.
Lussi A, Schlueter N, Rakhmatullina E, Ganss C. Dental erosion an overview with emphasis on chemical and histopathological aspects. Caries Res 2011;45 Suppl 1:2-12.
Salas MMS, Nascimento GG, Vargas-Ferreira F. Diet influenced tooth erosion prevalence in children and adolescents: results of a meta-analysis and meta-regression. J Dent 2015;42-50.
Smith BG, Robb ND. The prevalence of tooth wear in 1,007 dental patients. J Oral Rehabil 1996;23:232–239.
Marró ML, Aránguiz V, Ramirez V, Lussi A. Prevalence of erosive tooth wear in Chilean adults, 2016: A cross-sectional study. J Oral Rehabil 2020;47:467–472.
Lussi A, Jaeggi T. Chemical factors. Monogr Oral Sci 2006;20:77-87.
Zero DT. Etiology of dental erosion--extrinsic factors. Pt 2. Eur J Oral Sci 1996;104(2):162-77.
Stefanski T, Postek-Stefanska L. Possible ways of reducing dental erosive potential of acidic beverages. Aust Dent J 2014;59:280–288.
Shellis RP, Barbour ME, Jesani A, Lussi A. Effects of buffering properties and undissociated acid concentration on dissolution of dental enamel in relation to pH and acid type. Caries Res 2013;47(6):601-11.
Zero DT, Lussi A. Erosion: chemical and biological factors ofimportance to the dental practitioner. Int Dent J 2005;55:285–290.
Gatou T, Mamai-Homata E. Tooth wear in the deciduous dentition of 5–7-year-old children: risk factors. Clin Oral Investig 2011;16(3):923–933.
Muller-Bolla M, Courson F, Small-Faugeron V. Dental erosion in French adolescents. BMC Oral Health 2015.
Mulic A, Skudutyte-Rysstad R, Tveit AB. Risk indicators for dental erosive wear among 18-year-old subjects in Oslo, Norway. Eur J Oral Sci 2012;120:531–538.
Chrysanthakopoulos NA. Prevalence of tooth erosion and associated factors in 13-16-year old adolescents in Greece. J Clin Exp Dent 2012;4:60-6.
Lussi A, Portmann P, Burhop B. Erosion on abraded dental hard tissues by acid lozenges: an in situ study. Clin Oral Invest 1997;1:191–194.
Johansson AK, Lingström P, Birkhed D: Comparison of factors potentially related to the occurrence of dental erosion in high and low erosion groups. Eur J Oral Sci 2002;110:204–211.
Al Hadi A, Zawaideh FI, Al Hadithy RT. Risk indicators associated with dental erosion among Jordanian school children aged 12-14 years of age. Int J Paediatr Dent 2014; 24:56-68.
Millward A, Shaw L, Harrington E, Smith AJ. Continuous monitoring of salivary flow rate and pH at the surface of the dentition following consumption of acidic beverages. Caries Res 1997;31:44–49.
Johansson AK, Lingstrom P, Imfeld T, Birkhed D. Influence of drinking method on tooth surface pH in relation to dental erosion. Eur J Oral Sci 2004;112:484–489.
Duxbury AJ. Ecstasy: dental Implications. Br Dent J 1993;175:38.
Robb ND, Smith BG. Prevalence of pathological tooth wear in patients with chronic alcoholism. Br Dent J 1990;169:367–369.
Nunn JH, Ng SK, Sharkey I, Coulthard M. The dental implications of chronic use of acidic medicines in medically compromised children. Pharm World Sci 2001;23:118–119.
Atkinson JC, Wu AJ. Salivary gland dysfunction: causes, symptoms, treatment. Am Dent Assoc 1994;125:409–416.
Cassolato SF, Turnbull RS. Xerostomia: clinical aspects and treatment. Gerodontology 2003;20:64–77.
Imfeld T. Dental erosion. Definition, classification and links. Eur J Oral Sci 1996;104:151–155.
Scheutzel P. Etiology of dental erosion – intrinsic factors. Eur J Oral Sci 1996; 104: 178- 90.
Bartlett D. Intrinsic causes of erosion. Monogr Oral Sci2006;20:119–139.
Nunn JH. Prevalence of dental erosion and the implication sfor oral health. Eur J Oral Sci 1996;104:156–161.
Young WG. Diet and nutrition for oral health: advice for patients with tooth wear. Aust Dent Assoc News Bull 1995 July;8–10.
Rose KJ, Carey CM. Intensive swimming: Can it affect your patients’ smiles? J Am Dent Assoc 1995;126(10):1402–1406.
Chowdhury S, Alhooshani K, Karanfil T. Disinfection by products in swimming pool: occurrences, implications and future needs. Water Res 2014 Apr 15;53:68-109.
Lee J, Jun MJ, Lee MH, Lee MH, Eom SW, Zoh KD. Production of various disinfection by products in indoor swimming pool waters treated with different disinfection methods. Int J Hyg Environ Health 2010 Nov;213(6):465-74.
Schmalz C, Frimmel FH, Zwiener C. Trichloramine in swimming pools formation and mass transfer. Water Res 2011 Apr;45(8):2681-90.
Wang MC, Liu CY, Shiao AS, Wang T. Ear problems in swimmers. J Chin Med Assoc 2005;68:347–52.
Fernández-Luna Á, Burillo P, Felipe JL, del Corral J, García-Unanue J, Gallardo L. Perceived health problems in swimmers according to the chemical treatment of water in swimming pools. Eur J Sport Sci 2016;16:256–65.
Angione S, McClenaghan H, LaPlante A. A Review of chlorine in indoor swimming pools and its increased risk of adverse health effects. Int J Health Sci 2011; 2(1): 44–51.
Centerwall BS, Armstrong CW, Funkhouser LS, Elzay RP. Erosion of dental enamel among competitive swimmers at a gas-chlorinated swimming pool. Am J Epidemiol 1986 Apr;123(4):641-7.
Geurtsen W. Rapid general dental erosion by gas-chlorinated swimming pool water. Review of the literature and case report. Am J Dent 2000 Dec;13(6):291-3.
Lokin PA, Huysmans MC. Is Nederlands zwembadwater erosief? Dutch [Is Dutch swimming pool water erosive?]. Ned Tijdschr Tandheelkd 2004 Jan;111(1):14-6.
Scheper WA, van Nieuw Amerongen A, Eijkman MA. Orale aandoeningen bij zwemmers. Dutch [Oral conditions in swimmers]. Ned Tijdschr Tandheelkd.2005 Apr;112(4):147-8.
Wiegand A, Attin T. Occupational dental erosion from exposure to acids: a review. Occup Med 2007 May;57(3):169-76.
Buczkowska-Radlińska J, Łagocka R, Kaczmarek W, Górski M, Nowicka A. Prevalence of dental erosion in adolescent competitive swimmers exposed to gas-chlorinated swimming pool water. Clin Oral Investig 2013 Mar;17(2):579-83.
Bretz WA, Carrilho MR. Salivary parameters of competitive swimmers at gas- chlorinated swimming-pools. J Sports Sci Med 2013 Mar 1;12(1):207-208.
Baghele ON, Majumdar IA, Thorat MS, Nawar R, Baghele MO, Makkad S. Prevalence of dental erosion among young competitive swimmers: a pilot study. Compend Contin Educ Dent 2013 Feb;34(2):e20-4.
Rao KA, Thomas S, Kumar JK, Narayan V. Prevalence of dentinal hypersensitivity and dental erosion among competitive swimmers, Kerala, India. Indian J Community Med 2019 Oct-Dec;44(4):390-393.
Zebrauskas A, Birskute R, Maciulskiene V. Prevalence of dental erosion among the young regular swimmers in Kaunas, Lithuania. J Oral Maxillofac Res 2014 Jul 1;5(2):e6.
Lussi A. Dental erosion. Clinical diagnosis and case history taking. Eur J Oral Sci 1996;104:191–198.