INTRODUZIONE
Nel 1699 Antonie van Leeuwenhoek fu il primo a riferire di batteri nella cavità orale, nella quale descrisse la presenza di animalcules viventi (1). La bocca, quindi, è un luogo comune attraverso cui i batteri si manifestano ed entrano nel corpo. Pertanto, senza un’adeguata igiene orale, all’interno della bocca possono insorgere numerose malattie e complicazioni.
Prodotti come dentifricio e filo interdentale vengono utilizzati per mantenere l’igiene orale in condizioni ottimali. Tuttavia, dentifricio e filo interdentale spostano fisicamente i batteri solo in un altro sito. Diversamente dal collutorio cosmetico, il collutorio terapeutico è un prodotto che contiene principi attivi che uccidono attivamente i batteri.
Spesso l’alcol è un ingrediente attivo comune in molti dei collutori commerciali. L’alcol uccide i batteri dapprima disgregando la componente lipidica presente nella membrana cellulare protettiva esterna, facendo perdere a quest’ultima la sua integrità strutturale, quindi, mentre la membrana cellulare si disintegra, l’alcol può entrare nella cellula e svolgere la sua seconda attività battericida denaturando le proteine (2). Ciononostante, l’alcol, di per sé, a determinati livelli di concentrazione, rappresenta anche un fattore di rischio per malattie come il cancro orale (3).
Tra i principi attivi disponibili, la clorexidina è riconosciuta come un efficace battericida, ed è perciò contenuta a diverse concentrazioni in molti collutori disponibili sul mercato, utilizzati con successo nella riduzione della placca e dei microrganismi patogeni (4). Il meccanismo d’azione della clorexidina prevede una interazione con i componenti cellulari esterni e la membrana citoplasmatica, inducendo la perdita di componenti intracellulari e interazioni con componenti citoplasmatici.
Il danno ai soli strati cellulari esterni è insufficiente per indurre la morte cellulare (5). In ogni modo, sebbene efficace, la clorexidina ha alcuni effetti collaterali come discromie (pigmentazione bruna) dei denti, erosione della mucosa orale e alterazioni del gusto (6).
Oltre alla clorexidina, come sappiamo, esistono molti altri principi attivi battericidi, tra cui figurano anche alcuni enzimi. Scopo del presente studio è stato quello di verificare e confrontare l’effetto batteriostatico/battericida di 10 collutori, tra quelli più noti e commercializzati (Curasept ADS 012 Trattamento prolungato; Curasept ADS 020 Trattamento intensivo; Dentosan Trattamento Mese; Dentosan Azione intensiva; Elmex Sensitive Plus; Listerine Total Care; Listerine Zero Alcol; Oral B Complete; Tantum Verde Bocca; Zendium BioGum) su sei ceppi batterici: Acinetobacter baumanii, Escherichia coli, Moraxella catarrhalis, Staphylococcus aureus, Streptococcus pyogenes, Streptococcus pneumoniae.
MATERIALI E METODI
Materiali
Dalla ceppoteca dell’Ospedale San Salvatore (L’Aquila), Settore Microbiologia e Batteriologia sono stati prelevati i seguenti ceppi batterici utilizzati nel presente studio:
- Acinetobacter baumanii;
- Escherichia coli;
- Moraxella catarrhalis;
- Staphylococcus aureus;
- Streptococcus pyogenes;
- Streptococcus pneumoniae.
Presso farmacie o parafarmacie locali sono stati acquistati i seguenti collutori.
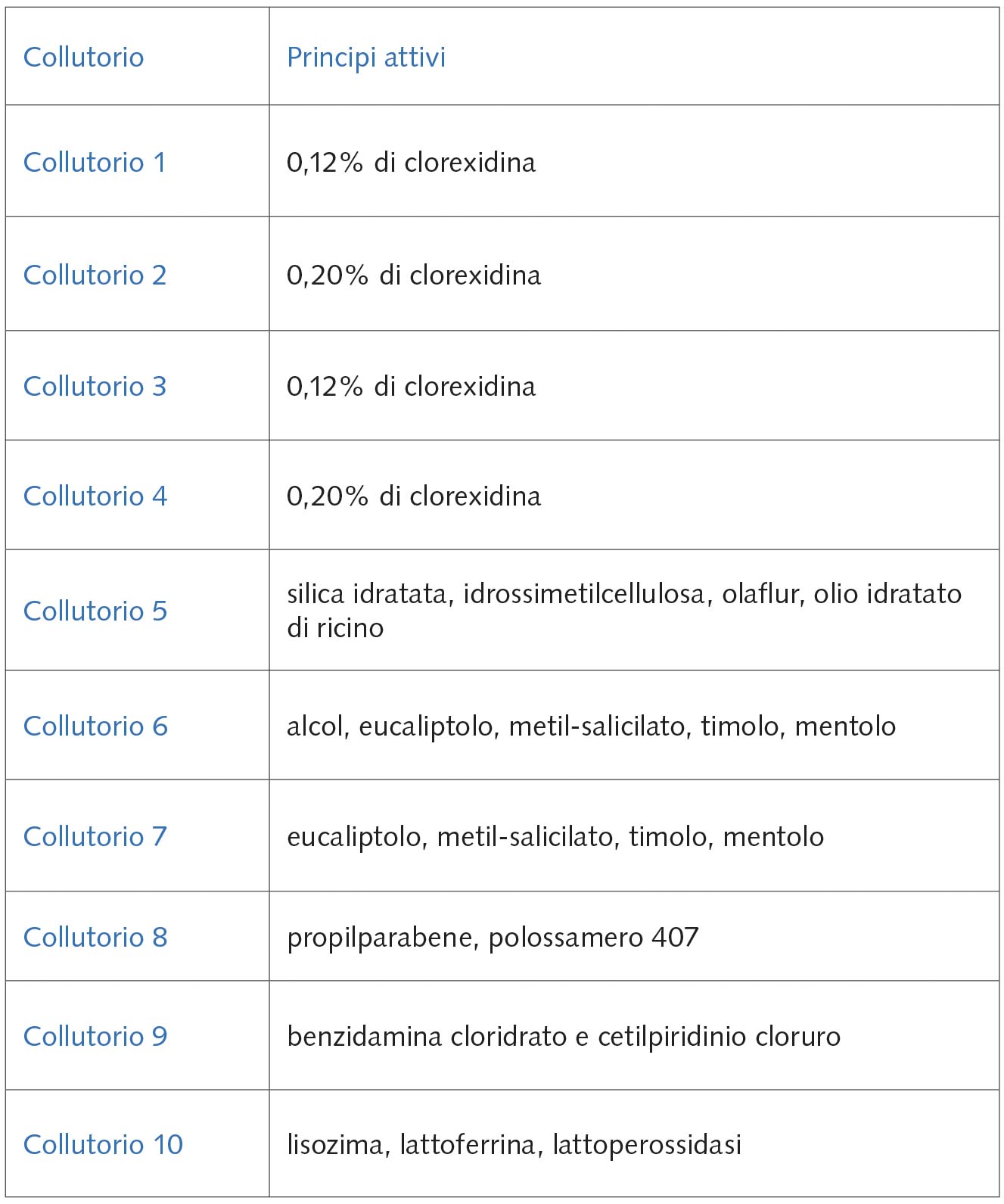
- Collutorio 1: contenente clorexidina 0,12% e sistema antidiscromie (Curasept ADS 012 Trattamento prolungato);
- Collutorio 2: contenente clorexidina 0,20% e sistema antidiscromie (Curasept ADS 020 Trattamento intensivo);
- Collutorio 3: contenente clorexidina 0,12% (Dentosan Trattamento Mese);
- Collutorio 4: contenente clorexidina 0,20% (Dentosan Azione intensiva);
- Collutorio 5: contenente silice idrata, idrossimetilcellulosa, olaflur e olio di ricino idrato (Elmex Sensitive Plus);
- Collutorio 6: contenente alcol, eucaliptolo, metil-salicilato, timolo, mentolo (Listerine Total Care);
- Collutorio 7: contenente eucaliptolo, metil-salicilato, timolo, mentolo (Listerine Zero Alcol);
- Collutorio 8: contenente propilparabene, polossamero 407 (Oral B Complete);
- Collutorio 9: contenente benzidamina cloridrato e cetilpiridinio cloruro (Tantum Verde Bocca);
- Collutorio 10: contenente lisozima, lattoferrina, lattoperossidasi (Zendium BioGum).
- I terreni di coltura Mueller Hinton Agar, Mueller Hinton Agar Sangue 5%, Mueller Hinton Broth, come pure l’Agar sono stati acquistati dalla Sigma-Aldrich (Merck KGaA, Germania).
Tutti gli altri reagenti erano di grado analitico.
Isolamento dei ceppi batterici
Tale procedimento è avvenuto tramite il ripasso con anse da 10 mL su piastre Mueller Hinton Agar o Mueller Hinton Agar Sangue 5%, a seconda del ceppo batterico. La conservazione dei ceppi è stata eseguita seminando e ripassando, ogni 48 ore, i batteri sempre su piastre Mueller Hinton Agar o Mueller Hinton Agar Sangue 5%, a seconda del ceppo batterico, quindi le piastre sono state poste a 36 °C in atmosfera con il 5% di CO2. In tutte le inoculazioni di batteri sono state utilizzate 107-108 CFU/mL.
Determinazione della concentrazione dei batteri
Per la determinazione della concentrazione, i batteri sono stati risospesi in soluzione fisiologica e agitati (vortex) per alcuni secondi. Diluizioni seriali di sospensioni batteriche, fino al raggiungimento di 0,5 McFarland, sono state quindi analizzate per mezzo di un nefelometro (PhoenixSpec; BD Diagnostics, Italia).
Preparazione delle piastre di Petri
In ognuna delle piastre Petri da 9 cm di diametro, preventivamente suddivise – dal basso – in sei settori a spicchio, venivano versati 20 mL di terreno di coltura costituito sempre da 0,63 g di Mueller Hinton Broth + 0,45 di Agar risospesi, di volta in volta, con:
- 20 mL di collutorio non diluito (1:1);
- 10 mL di collutorio + 10 mL di acqua distillata (collutorio diluito 1:2);
- 5 mL di collutorio + 15 mL di acqua distillata (collutorio diluito 1:4);
- 2,5 mL di collutorio + 17,5 mL di acqua distillata (collutorio diluito 1:8);
- 1,25 mL di collutorio + 18,75 mL di acqua distillata (collutorio diluito 1:16);
- 0,625 mL di collutorio + 19,375 mL di acqua distillata (collutorio diluito 1:32).
Come controllo veniva preparata una piastra sempre con 0,63 g di Mueller Hinton Broth + 0,45 di Agar, ma risospesi in acqua distillata. In ogni caso, prima del versamento nelle piastre di Petri, tutti i terreni di coltura venivano sterilizzati a 121 °C x 15 minuti. Le piastre venivano quindi lasciare gelificare overnight a temperatura ambiente.
Messa in coltura per la crescita batterica
In ognuno dei sei settori della piastra di Petri venivano caricati, al centro, 5 µL dello specifico ceppo batterico (107-108 CFU/mL). Dopo incubazione a 37 °C per 24 ore si procedeva a verificare la crescita o meno dei batteri nei diversi terreni di coltura e con una diversa concentrazione (diluizione) dei collutori, come pure nella piastra di controllo.
La verifica veniva effettuata anche dopo 48 ore, ma nessuna differenza è stata mai rilevata rispetto alla crescita riscontrata dopo 24 ore, pertanto tutti i risultati riportati nel presente studio si riferiscono alla crescita verificata dopo 24 ore di incubazione. Inoltre, tutti gli esperimenti sono stati eseguiti in duplicato, ma i risultati ottenuti sono stati sempre identici nell’ambito della stessa serie di duplicati.
RISULTATI
Le tabelle 1 e 2 mostrano il quadro completo relativo alla crescita o meno dei sei ceppi batterici utilizzati in funzione della diluizione dei collutori presi in considerazione. Come ipotizzabile, all’aumentare della diluizione (più bassa concentrazione di collutorio) si riscontrava una maggiore, generalizzata, crescita batterica, crescita che, invece, era completamente inibita quando il collutorio veniva utilizzato puro (Tab. 1, colonna A).
Tuttavia, va posto in evidenza che la mancata crescita dello Streptococcus pneumoniae in tutte le condizioni da noi saggiate, compreso il controllo con acqua al posto del collutorio (Tab. 1, 2), è da imputare al fatto che il terreno di coltura utilizzato e le condizioni di crescita non erano idonee alla crescita di questo batterio, che è stato utilizzato volutamente come controllo negativo interno.
Al contrario, la mancata crescita dello Streptococcus pyogenes in tutti i terreni dove era presente, seppure in piccola quantità il collutorio, è da imputare al fatto che questo batterio è risultato il più suscettibile all’azione dei collutori, anche alle maggiori diluizioni (Tab. 4). Infatti, lo stesso batterio cresceva regolarmente nella piastra di controllo (acqua al posto del collutorio) (Tab. 1, 2).
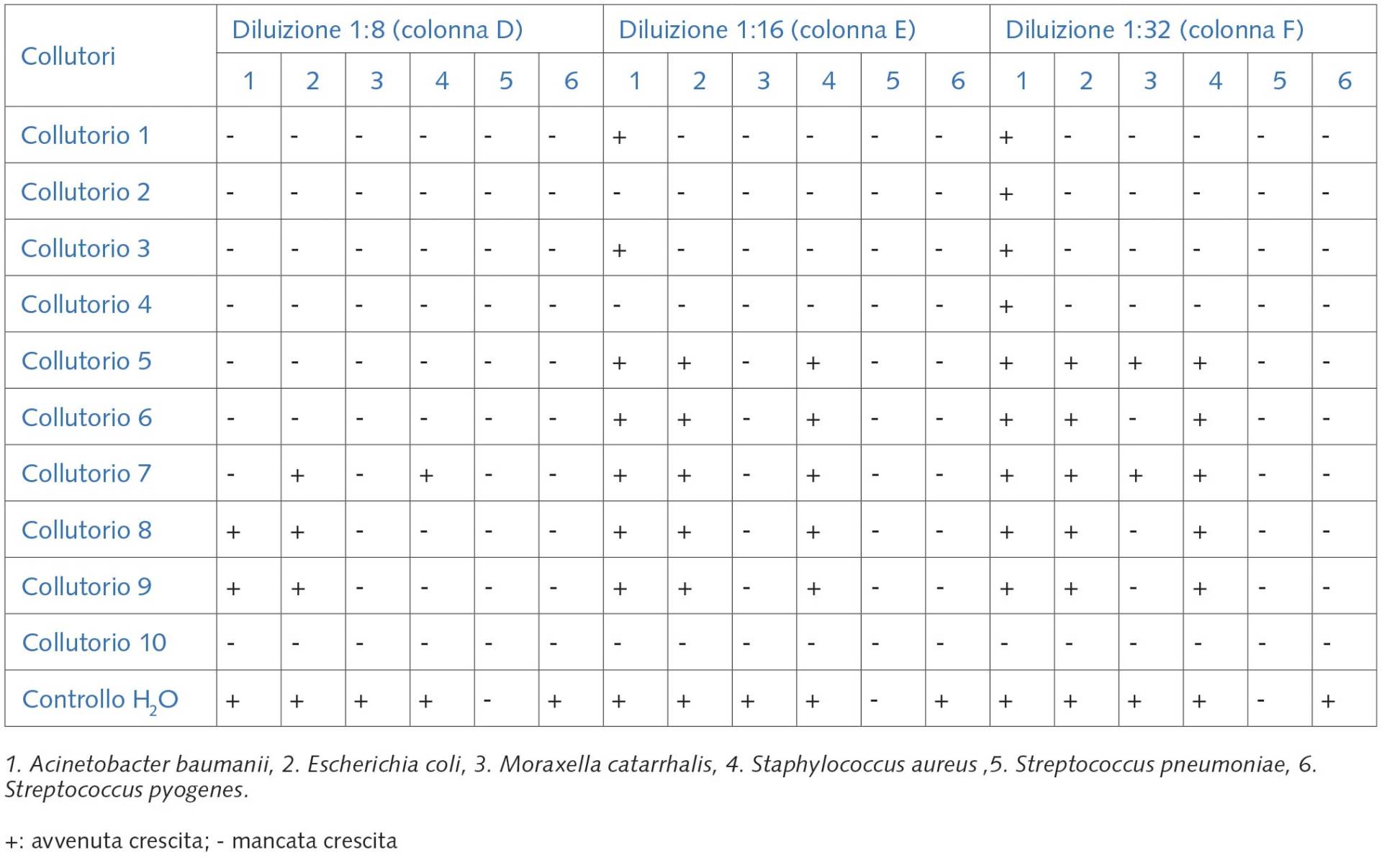
Dall’analisi e dalla combinazione delle tabelle 1 e 2 sono state dedotte le diluizioni batteriostatiche e quelle battericida svolte dai 10 collutori sui relativi sei ceppi batterici (Tab. 3), intendendo per diluizione batteriostatica quella nella quale si riscontrava la crescita (per esempio 1:16), ma al di sotto della quale (per esempio 1:8) il batterio non cresceva (diluizione battericida); e per diluizione battericida (per esempio 1:8) quella più bassa in grado di inibire la crescita, rispetto alla precedente diluizione (per esempio 1:4).
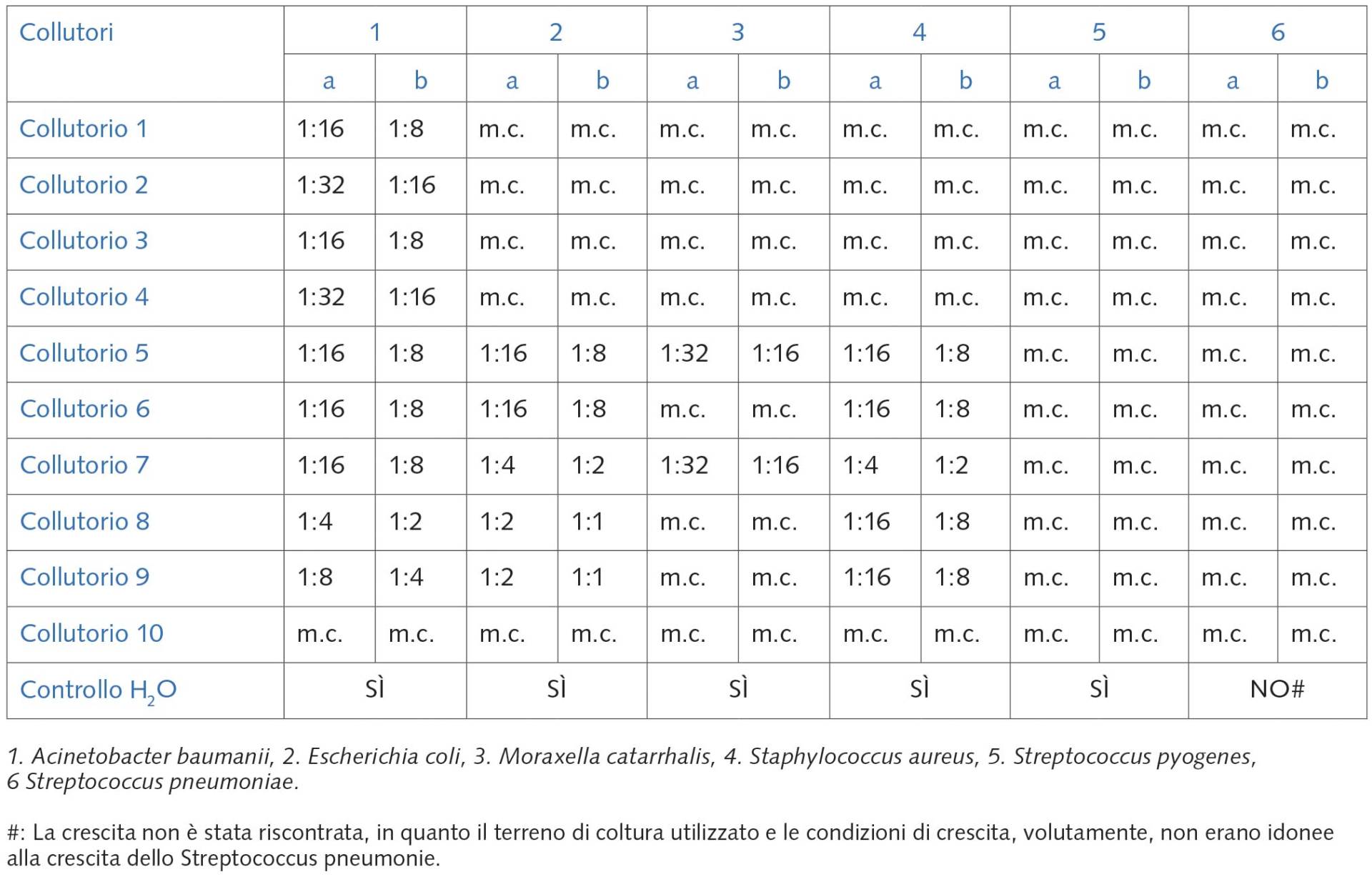
Per Controllo H2O solo crescita: SÌ/NO.
m.c.: mancata crescita.
Quindi dall’analisi della tabella 3 è stato possibile stilare una scala arbitraria di suscettibilità dei 5 ceppi batterici verso i 10 collutori (Tab. 4). Nelle nostre condizioni sperimentali l’Acinetobacter baumanii è risultato il batterio meno suscettibile all’azione dei collutori, mentre lo Streptococcus pyogenes quello maggiormente suscettibile.

Dall’analisi e dalla combinazione delle stesse tabelle 1 e 2 è stata dedotta, utilizzando una scala arbitraria, anche l’efficacia battericida dei 10 collutori verso i 5 ceppi batterici riportati nella tabella 4.
Come mostrato nella tabella 5, il collutorio 10 (lisozima, lattoferrina, lattoperossidasi) è risultato quello con la più potente azione battericida, seguito dai collutori con una concentrazione di clorexidina 0,20% (Collutorio 2 e Collutorio 4), che sono risultati quelli con una elevatissima azione battericida e, come immaginabile, quelli con clorexidina 0,12% (Collutorio 1 e Collutorio 3) con un’azione battericida, seppure alta, inferiore a quelli con la maggiore di clorexidina. Nelle nostre condizioni sperimentali, il Collutorio 7 (eucaliptolo, metil-salicilato, timolo, mentolo) è risultato quello con la più bassa azione battericida.
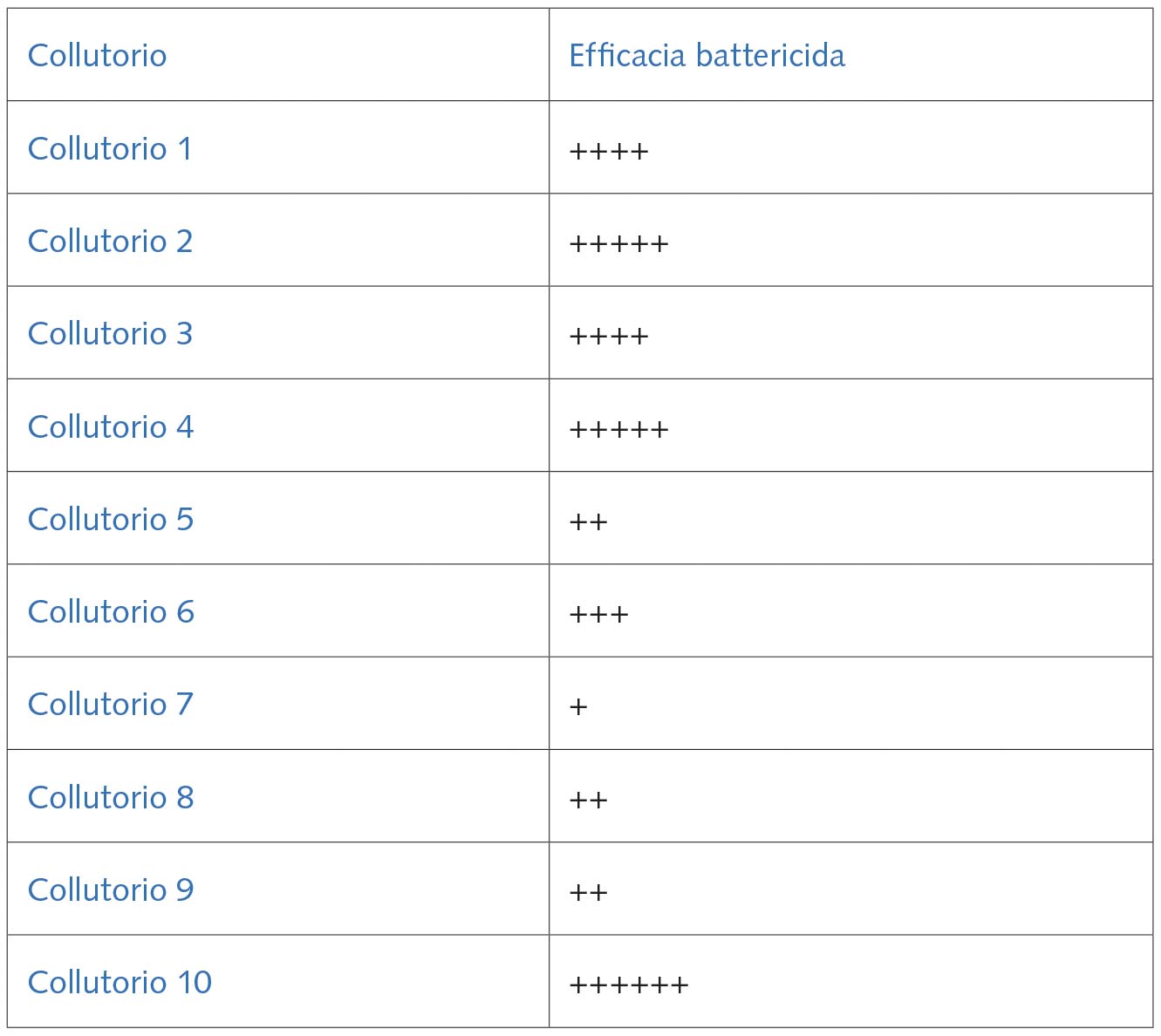
Scala arbitraria: ++++++: top; +++++: altissima; ++++: alta; +++: media; ++: bassa; +: bassissima.
DISCUSSIONE E CONCLUSIONI
I collutori sono spesso usati per ridurre il carico microbico nella cavità orale (collutori terapeutici) e per controllare o ridurre l’alitosi (collutori cosmetici), a seconda degli ingredienti contenuti (7).
Infatti, in presenza di placca sopragengivale e di gengivite, per abbattere e controllare la carica microbica del cavo orale prima di un intervento di chirurgia orale e parodontale, inclusa l’estrazione dentaria e il posizionamento implantare (8), vengono utilizzati collutori ad azione antimicrobica (generalmente a base di clorexidina).
I cosiddetti collutori cosmetici, invece, non sono necessariamente antimicrobici, ma forniscono un gusto gradevole e riducono l’alitosi (9).
Bisogna però segnalare anche che, sebbene gli effetti collaterali dell’uso dei collutori siano rari, occasionalmente vengono riportate reazioni allergiche a specifici ingredienti (per esempio la clorexidina) (10, 11).
Per il presente studio sono stati presi in considerazione 10 collutori (sia terapeutici sia cosmetici) tra quelli più noti e commercializzati e saggiati sia puri (diluizione 1:1) sia in diluizioni seriali fino a 1:32.
La tabella 6 riporta i principi attivi caratteristici di ciascun collutorio.
I sei ceppi batterici sono stati scelti in funzione del loro elevato interesse clinico, essendo tra quelli maggiormente isolati dal tratto oro-faringeo-respiratorio. In particolare, si riportano alcune caratteristiche dei batteri utilizzati nel presente studio.
- Acinetobacter baumanii: i batteri del genere Acinetobacter sono coccobacilli Gram-negativi, aerobi, non-fermentanti, immobili (da cui il nome akinetow = immobile) presenti nella popolazione batterica cutanea e, occasionalmente, sono agenti eziologici di infezioni respiratorie specialmente in ambiente nosocomiale. In considerazione di ciò, è stato scelto l’Acinetobacter baumanii in quanto quello più importante dal punto di vista clinico.
- Escherichia coli: il genere Escherichia comprende cinque specie, ma solo E. coli è clinicamente importante. Esso è un ospite comune nell’organismo umano, in quanto rappresenta la specie predominante della comunità batterica aerobia-anaerobia facoltativa residente nell’intestino crasso. Negli altri distretti corporei può comportarsi da patogeno opportunista, determinando una grande varietà di infezioni le cui manifestazioni cliniche sono difficilmente differenziabili per sintomi e segni da quelle sostenute da altri enterobatteri.
- Moraxella catarrhalis: appartiene a un gruppo di batteri dai confini sfumati, Gram-negativi, ossidasi-positivi, aerobi obbligati. Insieme agli altri due ceppi batterici del presente studio, cioè Streptococcus pneumoniae e Streptococcus pyogenes, è tra i batteri più frequentemente isolati dal tratto oro-faringeo-respiratorio. Negli ultimi anni sta richiamando una notevole attenzione quale patogeno umano emergente.
- Staphylococcus aureus: gli stafilococchi sono batteri Gram-positivi, aerobi-anaerobi facoltativi e crescono bene nei comuni terreni di coltura. Del genere Staphylococcus, S. aureus resta la specie patogena per eccellenza e, in assoluto, uno dei più comuni e importanti patogeni dell’uomo, sia in ambito comunitario sia in ambito ospedaliero.
- Streptococcus pyogenes: è uno dei più importanti e versatili, spesso dei più aggressivi, batteri patogeni per la specie umana. L’uomo è l’unico ospite naturale di S. pyogenes, a livello della cute e delle mucose. Una quota variabile, ma comunque significativa della popolazione umana (<5% negli adulti, 15-20% nei bambini), ospita in modo asintomatico lo S. pyogenes a livello faringeo. Colonie di S. pyogenes sviluppate in agar-sangue sono circondate, come gli streptococchi β-emolitici, da un alone molto ben evidente di emolisi completa.
- Streptococcus pneumoniae: è riconosciuto come uno dei principali patogeni umani. Si tratta di un batterio Gram-positivo, anaerobio facoltativo, catalasi-negativo, piuttosto delicato e muore facilmente fuori dall’organismo, infatti per poterlo far crescere nei terreni di coltura, nelle piastre è necessario aggiungere sangue (globuli rossi) quale fonte di catalasi. È un ospite frequente delle prime vie respiratorie, ma può raggiungere quelle più profonde provocando la polmonite. Per i nostri scopi, al fine di considerarlo come un controllo negativo, lo abbiamo inoculato in terreno di coltura privo di sangue, impedendone quindi la crescita e lo sviluppo.
A parte lo Streptococcus pneumoniae utilizzato come controllo negativo interno in quanto inoculato, appositamente, in terreno di coltura non idoneo alla sua crescita, e di cui non è stata riscontrata la crescita neanche in assenza di collutorio (Tab. 1, 2), nelle nostre condizioni sperimentali i restanti ceppi batterici sono risultati sensibili a tutti e 10 i collutori puri (diluizione 1:1) (Tab. 1, colonna A).
Come ipotizzabile, al crescere della diluizione del collutorio (fino a 1:32) (Tab. 2, colonna F) si riscontrava sempre una maggiore crescita globale, ma con rimarchevoli differenze sia tra i ceppi batterici sia tra i collutori utilizzati.
In particolare, secondo una scala arbitraria, tra i batteri da noi saggiati, il più suscettibile all’azione dei collutori risultava essere lo Streptococcus pyogenes, mentre quello meno suscettibile l’Acinetobacter baumanii (Tab. 3, 4).
Tra i collutori quello che secondo una scala arbitraria risultava possedere la maggiore efficacia battericida era il Collutorio 10, mentre quello con la più bassa azione battericida risultava essere il Collutorio 7 (Tab. 5). Come presumibile, anche i colluttori con clorexidina sia 0,12% sia 0,20% (Collutorio 1, 2, 3 e 4) mostravano una elevata (0,12%) o una elevatissima (0,20%) efficacia battericida (Tab. 2, 5), ma è interessante notare come la presenza di particolari enzimi antibatterici, quali lisozima, lattoferrina e lattoperossidasi nel Collutorio 10 (Tab. 6), anche alla diluzione più alta da noi saggiata (1:32), non permettesse la crescita nemmeno dell’Acinetobacter baumanii (Tab. 2).
D’altra parte tra i collutori da noi saggiati, il Collutorio 6, almeno sui ceppi batterici del presente studio, risultava possedere una efficacia battericida superiore al Collutorio 7 (Tab. 6), inducendo a presupporre che l’alcol, più che il mix di oli essenziali presente nel collutorio stesso, fosse responsabile di questa superiore attività antibatterica. Di conseguenza, il mix di oli essenziali presenti nel Collutorio 7, nelle nostre condizioni sperimentali, è risultato il principio attivo meno efficace quanto ad attività antibatterica; certamente, un diverso mix di oli essenziali e/o una maggiore concentrazione degli stessi potrebbe esibire una più rilevante attività antibatterica.
Inoltre, considerando i principali principi attivi presenti nei collutori da noi utilizzati (Tab. 6), dalla tabella 5 si evince che quelli presenti nel Collutorio 5 (silice idrata, idrossimetilcellulosa, olaflur, olio di ricino idrato), nel Collutorio 8 (propilparabene, polossamero 407) e nel Collutorio 9 (benzidamina cloridrato e cetilpiridinio cloruro), almeno sui ceppi batterici del presente studio, sembrano svolgere un’azione battericida molto simile, essendo la stessa, secondo una scala arbitraria, di bassa efficacia.
In conclusione, tutti i collutori puri, non diluiti, hanno dimostrato un effetto battericida totale, sebbene l’effetto batteriostatico/battericida diminuisse con l’aumentare della diluizione, fino a scomparire, tranne per il collutorio contenente enzimi e proteine che ha mostrato l’effetto battericida anche alla massima diluizione da noi saggiata.
Conflitto di interesse
Gli autori dichiarano nessun conflitto di interesse. Il presente studio è stato finanziato con fondi RIA 2019 (MIUR, Roma).
Ringraziamenti
Le piastre di Petri sono state gentilmente fornite dal dottor Ludovico Gemini.
Si ringrazia il dottor Giulio Di Michele (Direttore f.f. U.O.C. Medicina di Laboratorio, Ospedale San Salvatore, L’Aquila) per aver consentito e messo a disposizione l’utilizzo degli spazi e delle apparecchiature necessarie allo svolgimento di tutte le fasi sperimentali. Infine, si ringraziano le dottoresse Alessia Rosciano e Benedetta De Silvestro per la preparazione dei terreni di coltura.