L’ipersensibilità dentinale è definita come un “breve dolore acuto derivante da dentina esposta in risposta agli stimoli tipicamente termici, evaporativi, tattili, osmotici o chimici e che non può essere attribuito a qualsiasi altra forma di patologia dentale”(1), colpisce circa il 35% della popolazione, si manifesta soprattutto tra i 20 e i 50 anni di età, con maggior frequenza tra i 30 e i 40 anni e maggior prevalenza nel sesso femminile rispetto a quello maschile. Ha una prevalenza più alta, tra il 72% e il 98%, nei soggetti che presentano recessioni gengivali e in quelli affetti da parodontopatia (2,3).
Esistono diverse teorie che cercano di spiegare le cause dell’ipersensibilità dentinale: la teoria neurale, la teoria della trasduzione odontoblastica e la teoria idrodinamica (4, 5, 6).
La teoria più accreditata, è quella idrodinamica proposta da Brännström, in cui il flusso del liquido all’interno dei tubuli dentinali viene modificato da stimoli termici, tattili o chimici e questo movimento deforma il processo odontoblastico e le terminazioni nervose delle fibre nervose su cui sono presenti dei meccanocettori che captano lo stimolo doloroso.
La causa principale dell’ipersensibilità dentinale è l’esposizione della dentina con tubuli dentinali pervi. La dentina esposta è il risultato di:
- anomalie dei rapporti di continuità tra smalto e cemento che lasciano una parte di dentina esposta;
- recessioni gengivali;
- rimozione del tessuto duro che la ricopre, cioè smalto o cemento a seconda della zona del dente (2,7,8).
Per trattare l’ipersensibilità dentinale bisogna prima di tutto prevenirne le cause, eliminando i fattori di rischio (2,4,9,10):
- limitare l’assunzione di cibi e bevande acide/gassate ed evitare di tenerle in bocca a lungo o degustarle;
- bere con una cannuccia le bevande acide in modo da limitarne il contatto con i denti;
- assumere bevande alcaline (latte) o almeno neutre (acqua), dopo l’assunzione di bevande acide;
- dopo l’emesi o il reflusso non spazzolare subito i denti ma fare uno sciacquo con l’acqua o con il collutorio al fluoro;
- spazzolare i denti non subito dopo i pasti ma lasciar trascorrere un’ora per evitare l’effetto
- combinato di erosione acida e abrasione da spazzolamento;
- raffreddare la bevanda per ridurre il suo potenziale erosivo;
- utilizzare una corretta tecnica di spazzolamento;
- evitare di spazzolare i denti in modo aggressivo, evitare quindi spazzolini a setole dure e dentifrici troppo abrasivi (l’American Dental Association consiglia di utilizzare dentifrici con abrasività inferiore a 30 RDA in presenza di dentina esposta sensibile);
- evitare il lavaggio eccessivo in zona cervicale o la non detersione di questa zona;
- eliminare i contatti prematuri attraverso la correzione dell’occlusione.
Il trattamento per la gestione dell’ipersensibilità dentinale va impostato in modo graduale, partendo dal trattamento domiciliare tramite dentifrici o collutori desensibilizzanti. Nel caso in cui il dolore dovesse persistere, si passa a un trattamento professionale mini-invasivo tramite l’applicazione di gel, vernici, lacche, adesivi o cementi vetroionomerici. Se il dolore persiste ancora, si passa a un trattamento professionale odontoiatrico invasivo come otturazioni, corone, cure endodontiche, interventi di chirurgia parodontale con riposizionamento gengivale per coprire la dentina esposta, fino ad arrivare all’estrazione dell’elemento dentale (2,9).
Gli agenti desensibilizzanti possono essere classificati in base alla modalità di somministrazione (trattamento domiciliare o trattamento professionale), o in base al meccanismo d’azione (occlusione dei i tubuli dentinali o blocco della trasmissione nervosa) (2,4,8,9,11,12).
La disponibilità di una grande varietà di trattamenti per la gestione dell’ipersensibilità dentinale è un indicatore del fatto che non esiste ancora un agente desensibilizzante ideale. Nonostante il gran numero di studi effettuati su questo argomento, non si è ancora arrivati a un consenso comune circa il prodotto da considerarsi il gold standard (12).
Il presente studio clinico si pone come obiettivo quello di confrontare l’efficacia di due prodotti professionali nel gestire l’ipersensibilità dentinale:
- pasta da profilassi basata sulla tecnologia Pro-Argin all’8% di Arginina Carbonato di Calcio (Elmex Sensitive Professional™ desensitising paste; Gaba, Therwil, Svizzera);
- sospensione al 30% di Nano-idrossiapatite in alcol assoluto (Dentin Desensitizer; Ghimas, Casalecchio di Reno – BO).
MATERIALI E METODI
È stato effettuato uno studio sperimentale RCT (Randomised Controlled Trial) con metodica split-mouth.
Per condurre questo studio sono stati presi in considerazione alcuni suggerimenti tratti dall’articolo scientifico del Journal of Clinical Periodontology del 1997 “Guidelines for the design and conduct of clinical trials on dentine hypersensitivity” quali (13):
- prendere in considerazione i denti con sensibilità sia alta sia bassa;
- valutare solo i denti sensibili all’inizio dello studio;
- effettuare almeno due valutazioni, a T0 e T-finale;
- un solo sperimentatore per tutto il processo.
La metodica split-mouth è stata scelta poiché vantaggiosa per lo studio: vengono testati due prodotti differenti sullo stesso soggetto, ciò comporta una minor variabilità dei risultati perché il soggetto ha la stessa percezione del dolore in entrambe le emi-arcate destre e sinistre, ha le stesse abitudini di igiene orale, ha le stesse abitudini alimentari e ha gli stessi fattori psicosomatici (14).
I pazienti che riferivano di soffrire di ipersensibilità dentinale sono stati selezionati e sono stati invitati a firmare un consenso informato per partecipare allo studio.
Sono stati inclusi nello studio:
- soggetti di età compresa tra i 18-60 (compresi) di entrambi i sessi con un buono stato di salute generale;
- un minimo di due denti sensibili per emiarcata, testati tramite l’Air-Blast Test;
- denti con erosione cervicale / abrasione o recessioni gengivali.
Sono stati esclusi dallo studio:
- soggetti affetti da patologie orali;
- soggetti che avevano effettuato un trattamento per la malattia parodontale negli ultimi 12 mesi;
- soggetti che avevano effettuato uno sbiancamento negli ultimi 12 mesi;
- soggetti che erano già stati sottoposti a trattamenti desensibilizzanti negli ultimi 6 mesi;
- denti con restauri infiltrati;
- denti con sospetta pulpite;
- denti con carie;
- denti con smalto incrinato;
- denti utilizzati come pilastri per protesi parziali rimovibili;
- denti non sensibili poiché devitalizzati, necrotici o impianti;
- soggetti che assumono farmaci quali: anticonvulsivanti, antistaminici, antidepressivi,
- sedativi, tranquillanti, farmaci anti-infiammatori o analgesici quotidiani;
- donne incinte o che allattano;
- soggetti con una storia di allergia ai prodotti di prova.
In tutto sono stati reclutati 10 soggetti (5 maschi e 5 femmine) di età compresa tra i 24 e i 58 anni afferenti alla Clinica Odontostomatologia Dental School, dell’Università degli Studi di Torino, con almeno 2 elementi dentari affetti da ipersensibilità dentinale per emiarcata per un totale di 187 elementi dentari sensibili alla stimolazione termica con l’Air Blast Test.
Per ogni soggetto che ha partecipato allo studio, è stata compilata l’anamnesi medica, eseguito l’esame intra ed extraorale, compilata la cartella dentale e valutato il grado di ipersensibilità dentinale utilizzando lo Shiff Air Index (15) e la scala VAS, ricavati tramite l’Air-Blast test (15). Questa prima valutazione dell’ipersensensibilità corrisponde a T0.
L’Air Blast Test consiste nell’applicare un getto d’aria perpendicolare all’area del dente interessata per 1 secondo, a una distanza di 10 mm (1 cm) dalla giunzione amelocementizia del dente sulla regione vestibolare dello stesso, utilizzando una siringa aria-acqua dentale standard, a 3-4 atm, mentre i denti adiacenti vengono isolati con rulli di cotone o dalle dita dell’operatore come mostrato nella Figura 1.
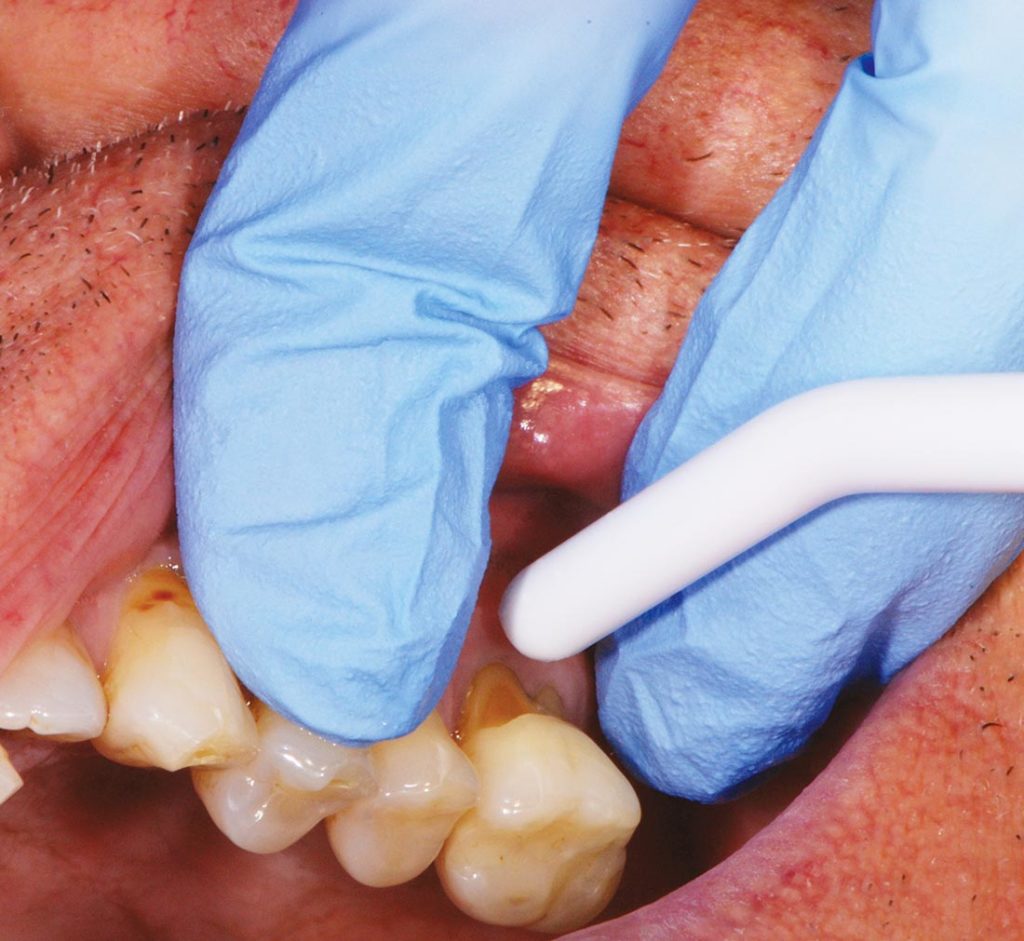
Lo Shiff Air Index quantifica il dolore in risposta allo stimolo evaporativo tramite punteggio assegnato dall’operatore come:
- 0, il soggetto non risponde a stimolazione con aria;
- 1, il soggetto risponde a stimolazione con aria ma non richiede l’interruzione;
- 2, il soggetto risponde a stimolazione con aria e richiede l’interruzione o si allontana dallo stimolo;
- 3, il soggetto risponde a stimolazione con aria, considera lo stimolo doloroso, ne richiede l’interruzione o se ne allontana.
Il paziente, in risposta allo stimolo evaporativo, ha dovuto quantificare il dolore provato secondo la scala VAS8: ha riferito un punteggio da 0 a 10, dove lo 0 indica l’assenza di dolore e il 10 il dolore più forte mai provato.
Tutti i soggetti sono stati valutati da un unico operatore sanitario igienista dentale.
È stata inoltre eseguita una seduta di igiene orale con strumenti ultrasonici e manuali ed è stato assegnato il trattamento professionale da applicare ai denti con sensibilità delle emiarcate destre e sinistre secondo il metodo di minimizzazione di Pocock del 1983 (13).
I prodotti desensibilizzanti sono stati applicati secondo l’assegnazione spiegata in precedenza, dopo un tempo compreso tra i 3 e i 7 giorni dalla seduta di igiene orale. In questa seduta è stato consigliato ai pazienti l’utilizzo di uno spazzolino con setole morbide utilizzato seguendo la tecnica di spazzolamento a rullo, ritenuta la più indicata perché atraumatica e facilmente riproducibile dal paziente.
L’applicazione della pasta da profilassi basata sulla tecnologia Pro-Argin all’8% di arginina carbonato di calcio è stata eseguita in ambiente umido, con una coppetta da profilassi, montata su contrangolo. È stato applicato una peasize del prodotto ed è stato applicato su tutta la zona sensibile del dente per tre secondi, applicando una pressione moderata con il contrangolo a velocità bassa (Fig. 2).
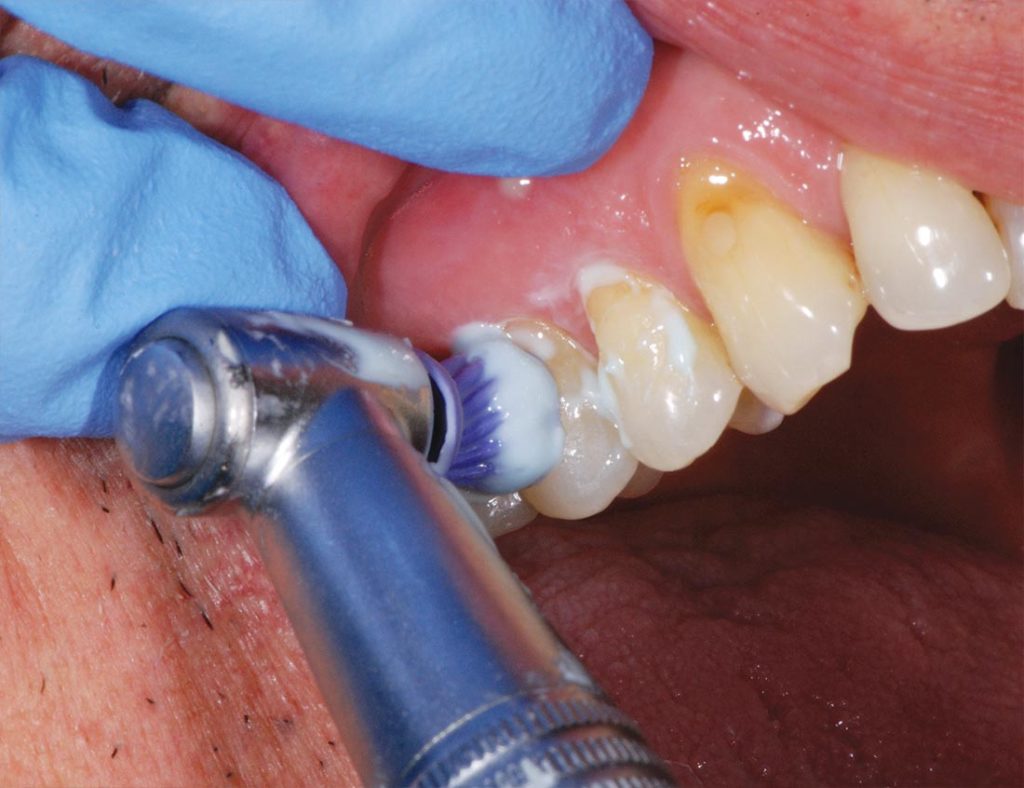
L’applicazione è stata ripetuta per due volte consecutive, intervallate da uno sciacquo d’acqua da parte del paziente.
L’applicazione della sospensione al 30% di Nano-idrossiapatite in alcol assoluto è stata eseguita in ambiente umido. Dopo aver agitato la fiala contenente la sospensione, il prodotto è stato applicato mediante pennellatura topica con microbrush (Fig. 3). L’applicazione è stata ripetuta per due volte consecutive, intervallate da uno sciacquo d’acqua da parte del paziente.
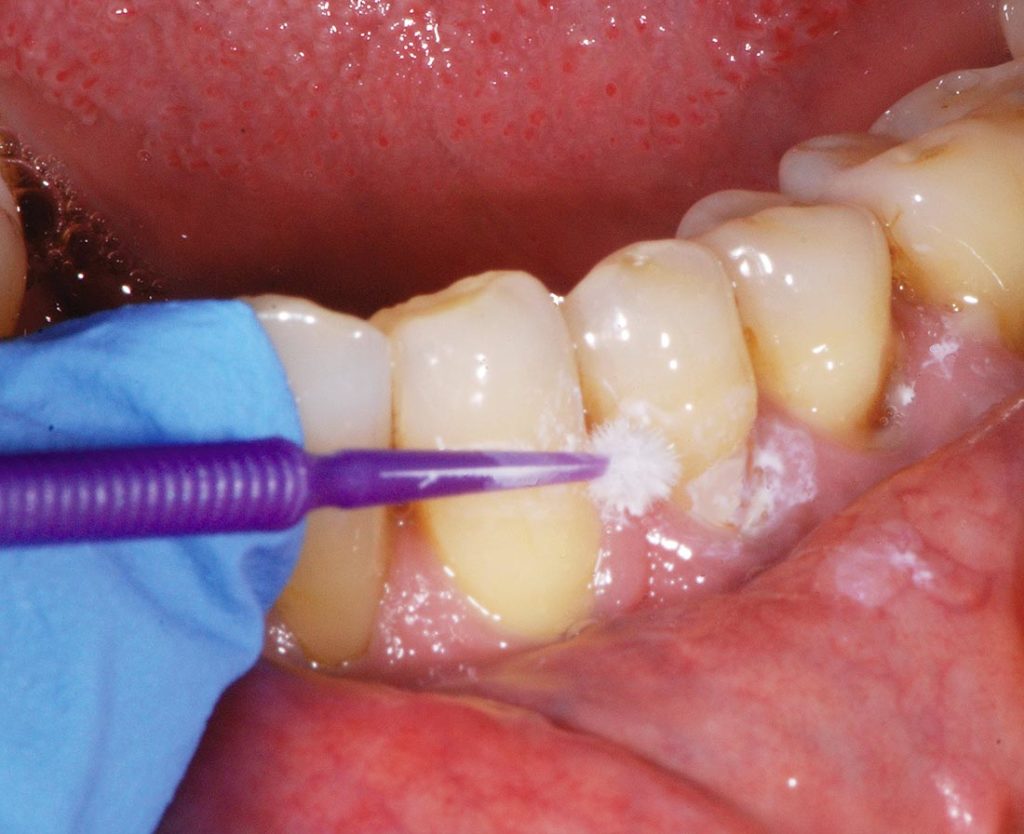
A distanza di quattro settimane dall’applicazione dei prodotti desensibilizzanti, sono stati testati nuovamente i denti trattati, tramite l’Air-Blast Test e Shiff Air Index, e i soggetti hanno quantificato nuovamente il dolore provocato dallo stimolo con un numero da 0 a 10 utilizzando la Scala VAS. Questa seconda valutazione dell’ipersensibilità corrisponde a T1.
I dati raccolti sono stati inseriti in un foglio di calcolo elettronico (Microsoft Excel 2013) e successivamente elaborati tramite il programma di elaborazione statistica R, in particolare con un pacchetto di R: R commander (Rcmdr). I dati sono poi stati usati per creare dei grafici per la rappresentazione dei risultati ottenuti.
Per il confronto dei dati tra i due campioni è stato usato il T-test per campioni indipendenti con significatività stabilita al 5% e confidenza al 95%, allo scopo di verificare l’esistenza di differenze statisticamente significative nella riduzione dei valori dell’indice qualitativo VAS.
Si è voluto inoltre verificare se l’utilizzo di uno dei due prodotti aumentava o diminuiva la differenza della Scala VAS rispetto all’altro.
Infine si è voluto valutare se avere un valore di ipersensibilià dentinale iniziale (al T0) maggiore o uguale a 5, avesse qualche influenza sull’efficacia dei prodotti.
RISULTATI
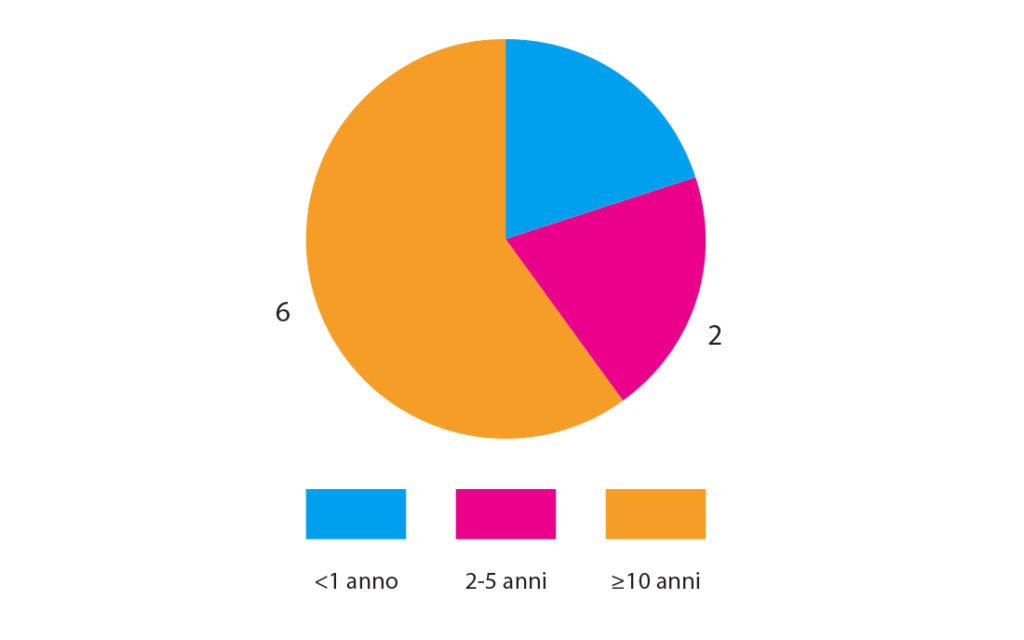
Dall’anamnesi si riscontra che 6 dei 10 soggetti soffrivano di ipersensibilità dentinale da 10 anni o più, due da 2 ai 5 anni e altri due soggetti da meno di 1 anno (Fig. 4).
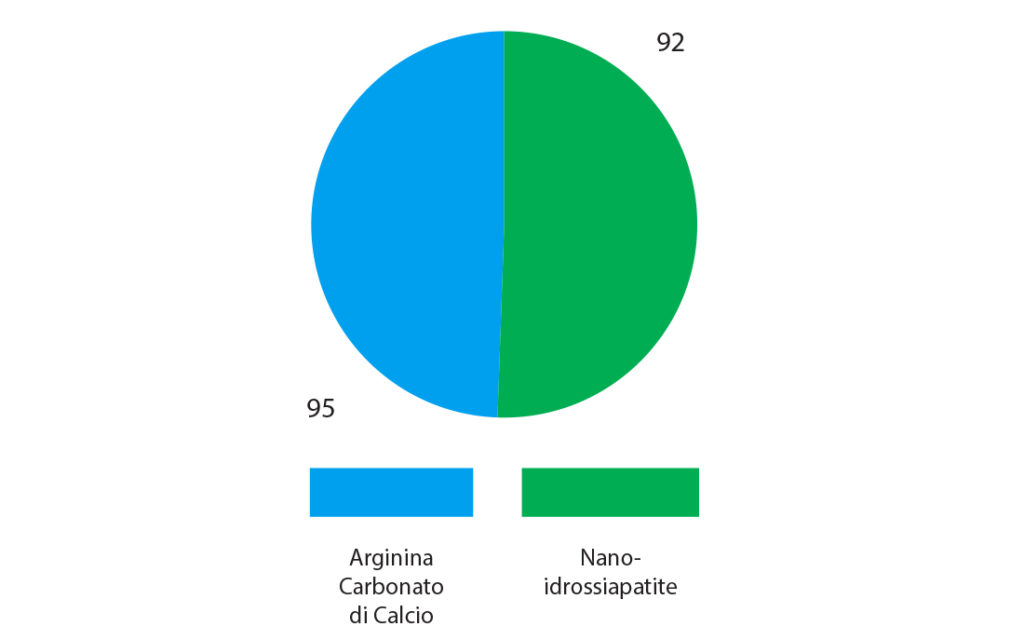
Gli elementi dentari affetti da ipersensibilità sono stati in seguito suddivisi in due gruppi, in maniera casuale, secondo il metodo di minimizzazione di Pocock, costituiti rispettivamente da 92 elementi dentari ipersensibili trattati con la pasta da profilassi a base di Arginina Carbonato di Calcio all’8% e 95 elementi sensibili trattati con la sospensione al 30% di Nano-idrossiapatite in alcol assoluto (Fig. 5).
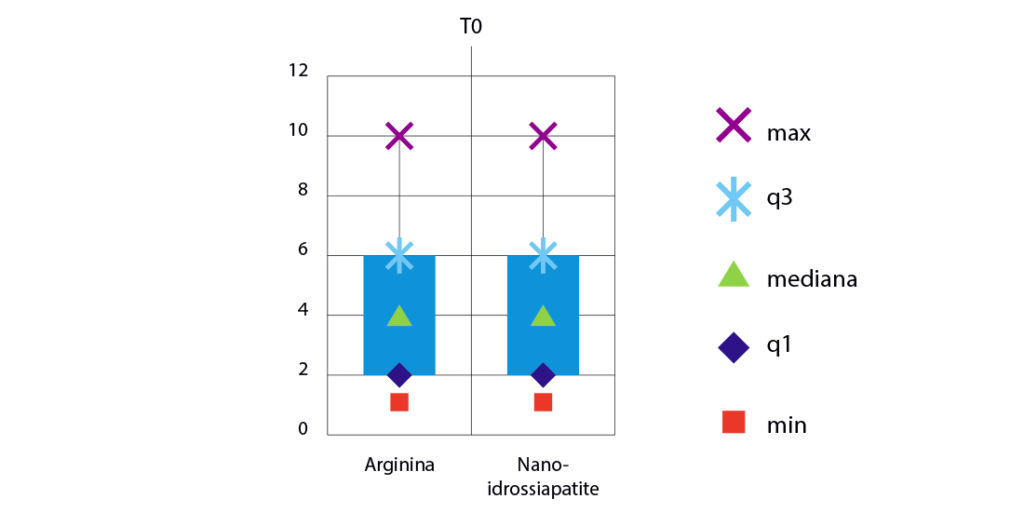
Al confronto tra i due gruppi, al T0, non si evidenziano differenze statisticamente significative, come si può notare dal terzo grafico (Fig. 6). Il valore di ipersensibilità media, stabilito secondo la scala VAS, per il gruppo trattato con l’Arginina è di 4,4 e per il gruppo trattato con la Nano-idrossiapatite è di 4,2.
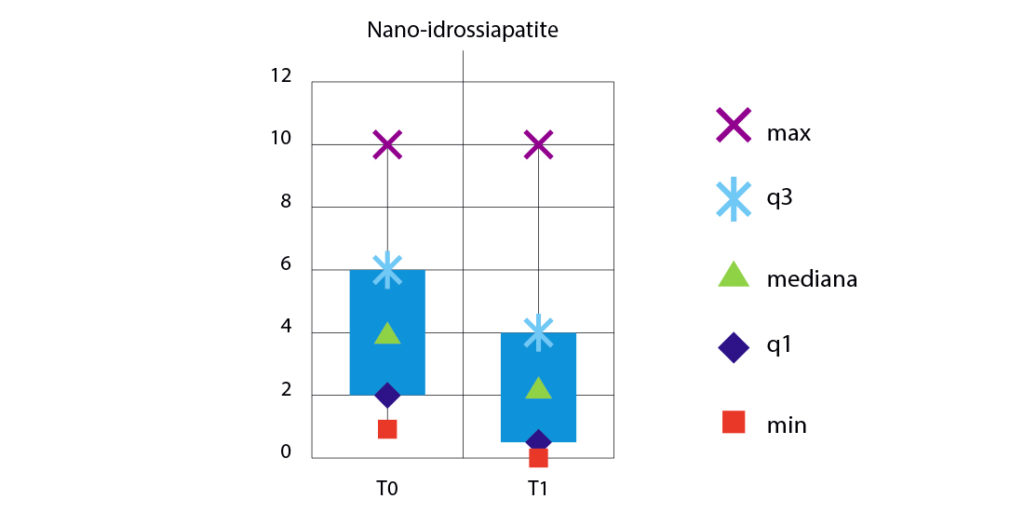
A distanza di un mese dall’applicazione dei due prodotti professionali, i pazienti hanno fornito nuovamente il grado di ipersensibilità per ogni dente trattato; i denti che erano ipersensibili al T0 sono stati rivalutati tramite l’Air-Blast Test e i valori di VAS forniti dai pazienti sono stati riportati in cartella. Dal quarto grafico (Fig. 7) si possono osservare i valori di ipersensibilità dentinale al T1 (1 mese dopo il trattamento).
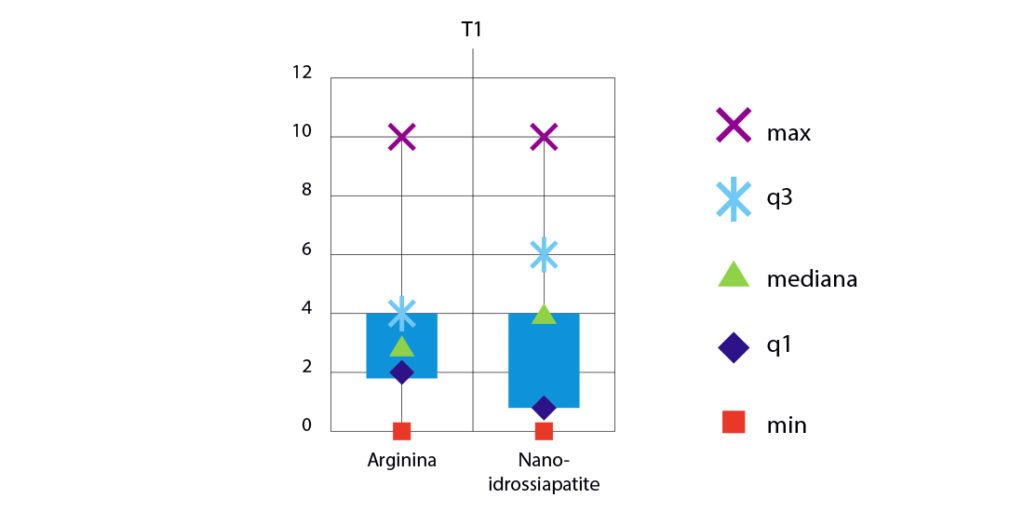
I valori medi dell’ipersensibilità dentinale, a un mese dal trattamento, sono 3,07 per il gruppo trattato con arginina e 2,48 per il gruppo trattato con nano-idrossiapatite.
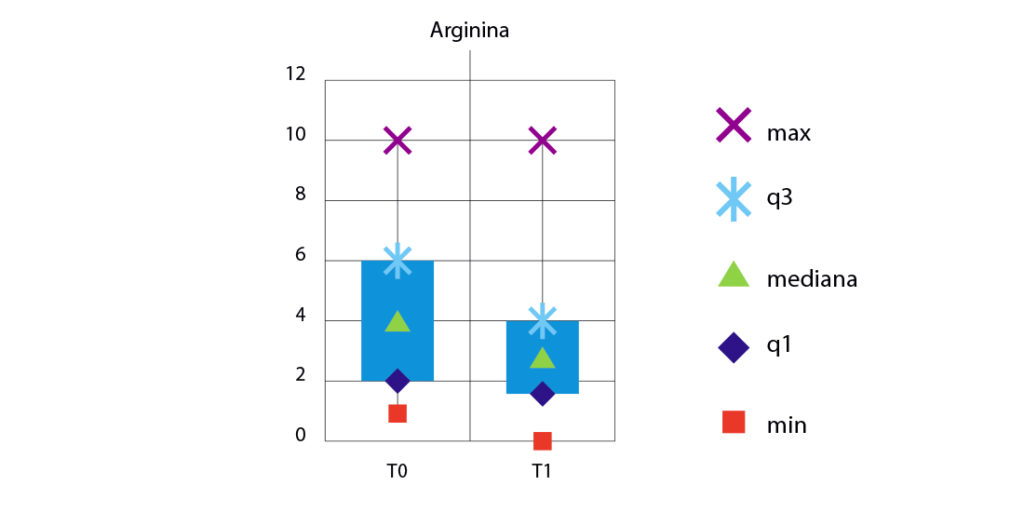
La media delle differenze T0-T1 è 1,33 per il gruppo trattato con l’arginina e 1,72 per il gruppo trattato con la nano-idrossiapatite. Dalle figure 8 e 9 si possono osservare i valori di ipersensibilità a confronto tra il T0 e T1 nei due gruppi: come si può notare in entrambi sono diminuiti i valori di ipersensibilità. Sono state calcolate le differenze tra i valori di VAS al T0 e T-finale (T0-T1) per i due gruppi e, in base a queste differenze, sono stati testati la normalità con il test di Shapiro-Wilk e l’omogeneità della varianza con il test F per due varianze.
Per quanto riguarda le varianze, per il gruppo trattato con arginina il W=0,97 e per il gruppo trattato con nano-idrossiapatite W=0,95, la distribuzione è normale in entrambi i gruppi.
Per quanto riguarda l’omogeneità delle varianze, il p-value risulta di 0,53 e, essendo stato posto a p-value >0,05, le varianze sono omogenee. Dato che i due gruppi sono risultati normali e omogenei si è potuto eseguire il T Test per campioni indipendenti, dai risultati si ottiene p-value=0,31 e, essendo p-value >0,05 si evince che la media della diminuzione della VAS dei due gruppi è uguale; non c’è quindi una differenza statisticamente significativa tra i due prodotti, ma entrambi sono ugualmente efficaci nel ridurre l’ipersensibilità dentinale.
Dai risultati del test di regressione lineare, prendendo come riferimento il prodotto a base di arginina, l’utilizzo del prodotto a base di nano-idrossiapatite aumenta di 0,39 la differenza di VAS rispetto al prodotto all’arginina. Ciò significa che il prodotto a base di nano-idrossiapatite sembra essere più efficace nel ridurre l’ipersensibilità dentinale ma, se si osserva il p-value, che è di 0,30, ed è un p-value >0,05, non si può affermare che questa differenza sia statisticamente significativa.
Inoltre si è voluto valutare se avere un valore di ipersensibilità dentinale iniziale (al T0) maggiore o uguale a 5, avesse qualche influenza sull’efficacia del prodotto.
Applicando il test di regressione multivariato si sono prese in considerazione sia la variabile “prodotto utilizzato” sia la variabile “VAS≥5 al T0” rispetto alla variabile “differenza T0-T1” e si è dimostrato che avere un valore di VAS ≥5 al T0 aumenta di 2,78 volte la differenza di VAS, rispetto a un valore di VAS <5 a T0. Essendo il valore 1,9 e -15, p-value<0,05, si può affermare che avere un valore di VAS ≥5 al T0 aumenta l’efficacia di entrambi i prodotti in maniera statisticamente significativa.
DISCUSSIONE
Dai risultati del T-test si evince che l’efficacia dei prodotti utilizzati in questo studio è paragonabile poiché sono entrambi efficaci nel ridurre l’ipersensibilità dentinale. Pertanto, con l’utilizzo della pasta da profilassi basata sulla tecnologia Pro-Argin all’8% di arginina carbonato di calcio o la sospensione al 30% di nano-idrossiapatite in alcol assoluto si ottiene una diminuzione statisticamente significativa dell’ipersensibilità dentinale del 30,22%, per l’arginina e del 40,95% per la nano-idrossiapatite; dato ottenuto a un mese dall’applicazione professionale dei prodotti.
Inoltre si è dimostrato che avere un valore di ipersensibilità dentinale iniziale uguale o superiore a 5, secondo la scala VAS, aumenta di 2,78 volte l’efficacia dei prodotti utilizzati.
Questo studio conferma i dati riportati in letteratura, secondo i quali non è ancora stato sperimentato un prodotto che si possa considerare il “gold standard” nel trattamento dell’ipersensibilità dentinale.
I limiti dello studio sono stati la bassa numerosità del campione e il tempo di osservazione che è limitato a un mese.
Inoltre, essendo uno studio basato sulla scala soggettiva del dolore, la scala VAS, i risultati non sono oggettivi. Pertanto sono necessari ulteriori studi che prendano in considerazione più elementi dentali ipersensibili e che abbiano un periodo di osservazione maggiore.
CONCLUSIONI
L’ipersensibilità dentinale è un problema relativamente comune riscontrato nella pratica odontoiatrica clinica: ne soffre circa il 35% della popolazione. Questa condizione può portare a problemi sia fisici sia psicologici per il paziente e può avere un effetto negativo sulla qualità della vita di una persona.
La causa di questa patologia è da attribuire all’esposizione della dentina con tubuli dentinali pervi, questo può essere dovuto ad anomalie dei rapporti di continuità tra smalto e cemento che lasciano una parte di dentina esposta, alla rimozione del tessuto duro che ricopre la dentina, cioè smalto o cemento, o a recessioni gengivali.
Sebbene l’ipersensibilità dentinale sia un sintomo diffuso e tra i più fastidiosi, tra i numerosi trattamenti disponibili, non è ancora stato identificato un trattamento che possa rappresentare il “gold standard”.
I risultati del presente studio dimostrano che sia la pasta da profilassi a base di arginina carbonato di calcio sia la sospensione a base di nano-idrossiapatite sono efficaci nel ridurre la sensibilità dentinale soprattutto in casi in cui la sensibilità iniziale riferita dal paziente sia alta.
Il limite dello studio è dovuto al fatto che i dati ricavati dal trial clinico si rifanno a un periodo temporale circoscritto a un mese.
Ringraziamenti
Questo lavoro è stato realizzato grazie al supporto tecnico di Ghimas e Gaba International.










