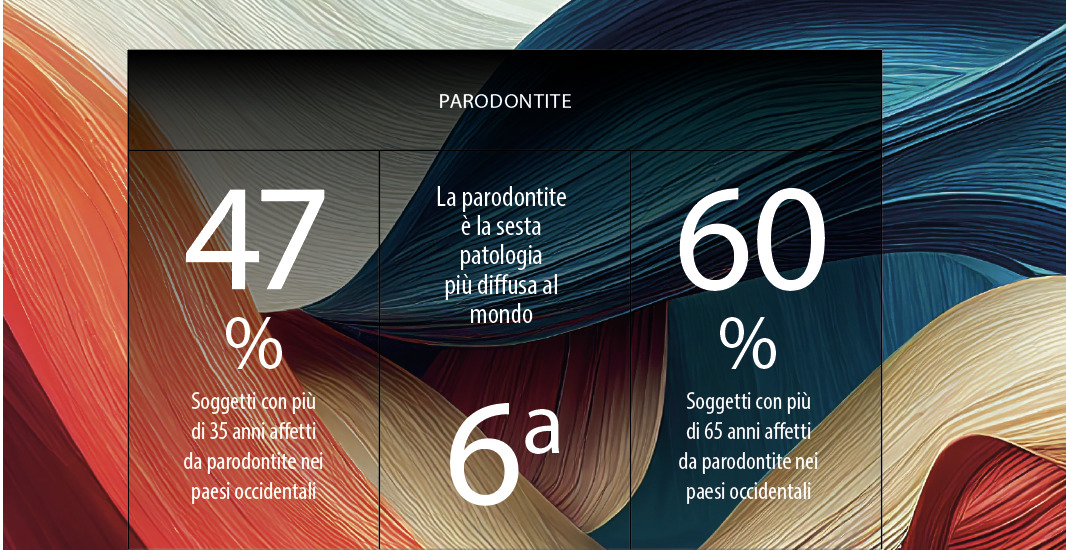
Le malattie croniche rappresentano uno dei principali ostacoli al benessere delle popolazioni (1-5), essendo la causa di oltre il 60% dei decessi a livello mondiale. Un aspetto comune a molte malattie croniche è la relazione con gli stili vita, in particolar modo il fumo, la dieta e l’attività, o meglio inattività, fisica. E in tal senso l’Organizzazione Mondiale della Sanità indica nelle strategie di prevenzione lo strumento chiave per la lotta a tali patologie e alle relative complicanze che possono portare all’obitus. Per quanto riguarda la relazione con la salute orale, la letteratura scientifica riporta anche l’associazione tra parodontopatie e alcune condizioni quali patologie cardiovascolari, respiratorie, diabete, artrite reumatoide ed esiti di gravidanza (6,7). Nei paesi occidentali la parodontite colpisce il 47% dei soggetti con più di 35 anni e il 60% sopra i 65 anni, rappresentando la sesta patologia più diffusa al mondo (8). Nell’etiopatogenesi della parodontite si attribuisce grande importanza non solo agli stili di vita non corretti, come fumo e cattive abitudini di igiene orale, ma anche a fattori come la suscettibilità individuale su base genetica e la presenza di patologie sistemiche che possono accentuare gli effetti destruenti specifici (6-9). Nella parodontite il normale equilibrio tra l’azione della placca batterica dentale e le difese immunitarie è alterato e porta a una imperfetta regolazione della risposta infiammatoria con conseguente aumento della distruzione del parodonto marginale. Gli effetti della parodontite vanno al di là del cavo orale, poiché si verifica una disseminazione per via ematogena dei batteri, dei loro prodotti e dei mediatori dell’infiammazione. In tal modo i batteri parodontopatogeni possono penetrare nei tessuti gengivali e, da lì, nel circolo ematico, dando luogo a una intensa risposta infiammatoria locale con riflessi sistemici ed è così che possono provocare patologie più o meno serie anche in organi o apparati lontani da quello di partenza. Chi soffre di parodontite ha valori di granulociti neutrofili circolanti e parametri infiammatori sistemici, come la proteina C reattiva, più elevati rispetto alle persone sane. In particolare, quest’ultimo parametro è un ottimo predittore per lo sviluppo di malattie ischemiche, aterosclerosi e imperfetto controllo metabolico del diabete. Per tali ragioni è importante conoscere queste correlazioni e pertanto proponiamo una breve carrellata delle problematiche di più comune riscontro nella pratica clinica.
 Malattia parodontale e diabete
Malattia parodontale e diabete
Il diabete mellito è una delle più importanti malattie croniche, con un trend in netta crescita: ne sono affette circa 180-200 milioni di persone al mondo (10) causando ogni anno un milione e duecentocinquantamila vittime. Il diabete mellito è caratterizzato dall’aumento della concentrazione di glucosio nel sangue a causa di un difetto assoluto o relativo di insulina, l’ormone indispensabile per il metabolismo degli zuccheri. Tutti gli zuccheri semplici e complessi (amidi), che vengono assunti con l’alimentazione, sono trasformati nel corso della digestione in glucosio, il quale rappresenta la principale fonte di energia per i muscoli e gli organi (1-5, 12,13). Affinché il glucosio possa fare il suo ingresso nelle cellule e consentire all’organismo di utilizzarlo per i processi energetici all’interno delle cellule (14), è necessaria la presenza dell’insulina. Quando quest’ultima è prodotta in quantità non sufficiente dal pancreas oppure le cellule dell’organismo non rispondono alla sua presenza, nel sangue si creano livelli di glucosio più alti del normale (iperglicemia) favorendo, così, la comparsa del diabete.
 La concentrazione di glucosio nel sangue si misura con la glicemia. In soggetti sani, che hanno una vita regolare e un’alimentazione corretta, i valori della glicemia generalmente si mantengono nell’arco della giornata tra i 60 e i 130 mg/dl. A digiuno, i valori glicemici possono variare dai 70 ai 110 mg/dl; tra 110 e 125 mg/dl si parla di alterata glicemia a digiuno (IFG), che dovrebbe indurre il paziente a porre maggiore attenzione agli stili di vita e, in particolare, all’alimentazione. Valori di glicemia uguali o superiori a 126 mg/dl, secondo l’American Diabetes Association (15), sono da considerarsi probabili sintomi di diabete. Valori di glicemia compresi fra 140 e 200 mg/dl dopo un carico di glucosio definiscono, invece, la ridotta tolleranza al glucosio (IGT). IFG e IGT possono evolvere nel tempo verso un diabete conclamato, la diagnosi è certa con un valore di glicemia di 200 mg/dl, rilevato in qualunque momento della giornata o due ore dopo un carico di glucosio. Nel linguaggio comune con il termine diabete ci si riferisce solitamente al diabete mellito, ma in realtà esiste anche un’altra condizione patologica detta diabete insipido; queste due patologie non hanno né cause, né sintomi in comune tranne la poliuria. Il diabete mellito di tipo 1 (insulinodipendente) si manifesta prevalentemente nell’infanzia e nell’adolescenza, anche se non sono rari i casi di insorgenza nell’età adulta, e per questo in passato è stato denominato diabete infantile. Il diabete mellito di tipo 2 (non insulinodipendente) è la forma più diffusa al mondo, pari a circa il 7% della popolazione italiana (ma è probabile che siano di più visto che molti non sanno di averlo). Il diabete mellito rientra nella categoria delle malattie autoimmuni perché è causata dalla produzione di autoanticorpi (anticorpi che distruggono tessuti e organi propri non riconoscendoli come appartenenti al corpo ma come estranei) che attaccano le cellule b delle isole di Langerhans che all’interno del pancreas sono deputate alla produzione di insulina. Come conseguenza, la produzione di questo ormone si riduce, fino ad azzerarsi completamente, dando luogo a una situazione di eccesso di glucosio nel sangue: l’iperglicemia (17). La mancanza o la scarsità di insulina, quindi, non consente al corpo di utilizzare gli zuccheri introdotti attraverso l’alimentazione che vengono così eliminati con le urine. In questa situazione l’organismo è costretto a produrre energia in altri modi, principalmente attraverso il metabolismo dei grassi, il che comporta la produzione dei cosiddetti corpi chetonici. L’accumulo di corpi chetonici nell’organismo, se non si interviene per tempo, può portare a conseguenze molto pericolose fino al coma. Esiste una relazione bidirezionale tra glicemia e deterioramento delle gengive (10,13): l’iperglicemia ha un impatto negativo sulla salute orale, essendo associata a un aumento del rischio e della gravità della parodontite e la gravità della malattia parodontale influisce negativamente sul controllo glicemico. Infatti, il controllo del diabete è più difficile se il paziente soffre anche di parodontite (comorbidità). Inoltre, i pazienti diabetici hanno tre volte più probabilità di sviluppare malattie gengivali. E in effetti la parodontite è considerata la sesta complicanza del diabete (16). In pratica, i soggetti sani con parodontite mostrano probabilità più alte di sviluppare prediabete e diabete, e i pazienti affetti da parodontite grave hanno un più alto rischio di sviluppare il diabete di tipo 2. Per contro, i pazienti diabetici con un buon controllo della glicemia hanno poche probabilità di contrarre la parodontite così come i pazienti non diabetici. L’aumento della suscettibilità del paziente diabetico trova spiegazione nei meccanismi mediati dall’iperglicemia che inducono sia una risposta immunitaria deficitaria, sia un aumento dello stress ossidativo e dell’infiammazione con impatto sul decorso della malattia e sulla disbiosi a livello del biofilm.
La concentrazione di glucosio nel sangue si misura con la glicemia. In soggetti sani, che hanno una vita regolare e un’alimentazione corretta, i valori della glicemia generalmente si mantengono nell’arco della giornata tra i 60 e i 130 mg/dl. A digiuno, i valori glicemici possono variare dai 70 ai 110 mg/dl; tra 110 e 125 mg/dl si parla di alterata glicemia a digiuno (IFG), che dovrebbe indurre il paziente a porre maggiore attenzione agli stili di vita e, in particolare, all’alimentazione. Valori di glicemia uguali o superiori a 126 mg/dl, secondo l’American Diabetes Association (15), sono da considerarsi probabili sintomi di diabete. Valori di glicemia compresi fra 140 e 200 mg/dl dopo un carico di glucosio definiscono, invece, la ridotta tolleranza al glucosio (IGT). IFG e IGT possono evolvere nel tempo verso un diabete conclamato, la diagnosi è certa con un valore di glicemia di 200 mg/dl, rilevato in qualunque momento della giornata o due ore dopo un carico di glucosio. Nel linguaggio comune con il termine diabete ci si riferisce solitamente al diabete mellito, ma in realtà esiste anche un’altra condizione patologica detta diabete insipido; queste due patologie non hanno né cause, né sintomi in comune tranne la poliuria. Il diabete mellito di tipo 1 (insulinodipendente) si manifesta prevalentemente nell’infanzia e nell’adolescenza, anche se non sono rari i casi di insorgenza nell’età adulta, e per questo in passato è stato denominato diabete infantile. Il diabete mellito di tipo 2 (non insulinodipendente) è la forma più diffusa al mondo, pari a circa il 7% della popolazione italiana (ma è probabile che siano di più visto che molti non sanno di averlo). Il diabete mellito rientra nella categoria delle malattie autoimmuni perché è causata dalla produzione di autoanticorpi (anticorpi che distruggono tessuti e organi propri non riconoscendoli come appartenenti al corpo ma come estranei) che attaccano le cellule b delle isole di Langerhans che all’interno del pancreas sono deputate alla produzione di insulina. Come conseguenza, la produzione di questo ormone si riduce, fino ad azzerarsi completamente, dando luogo a una situazione di eccesso di glucosio nel sangue: l’iperglicemia (17). La mancanza o la scarsità di insulina, quindi, non consente al corpo di utilizzare gli zuccheri introdotti attraverso l’alimentazione che vengono così eliminati con le urine. In questa situazione l’organismo è costretto a produrre energia in altri modi, principalmente attraverso il metabolismo dei grassi, il che comporta la produzione dei cosiddetti corpi chetonici. L’accumulo di corpi chetonici nell’organismo, se non si interviene per tempo, può portare a conseguenze molto pericolose fino al coma. Esiste una relazione bidirezionale tra glicemia e deterioramento delle gengive (10,13): l’iperglicemia ha un impatto negativo sulla salute orale, essendo associata a un aumento del rischio e della gravità della parodontite e la gravità della malattia parodontale influisce negativamente sul controllo glicemico. Infatti, il controllo del diabete è più difficile se il paziente soffre anche di parodontite (comorbidità). Inoltre, i pazienti diabetici hanno tre volte più probabilità di sviluppare malattie gengivali. E in effetti la parodontite è considerata la sesta complicanza del diabete (16). In pratica, i soggetti sani con parodontite mostrano probabilità più alte di sviluppare prediabete e diabete, e i pazienti affetti da parodontite grave hanno un più alto rischio di sviluppare il diabete di tipo 2. Per contro, i pazienti diabetici con un buon controllo della glicemia hanno poche probabilità di contrarre la parodontite così come i pazienti non diabetici. L’aumento della suscettibilità del paziente diabetico trova spiegazione nei meccanismi mediati dall’iperglicemia che inducono sia una risposta immunitaria deficitaria, sia un aumento dello stress ossidativo e dell’infiammazione con impatto sul decorso della malattia e sulla disbiosi a livello del biofilm.
 La tendenza all’iperglicemia è regolata dall’infiammazione sistemica elevata del soggetto affetto da parodontite e da un complesso meccanismo che comprende:
La tendenza all’iperglicemia è regolata dall’infiammazione sistemica elevata del soggetto affetto da parodontite e da un complesso meccanismo che comprende:
- elevata produzione citochinica, che potrebbe contribuire all’insulinoresistenza tramite la modificazione dell’insulin receptor substrate-1;
- alterazione della funzione adipocitaria con aumento di acidi grassi liberi;
- calo della produzione di ossido nitrico endoteliale.
I pazienti con parodontite e diabete di tipo 1 o 2 rispetto a pazienti con il solo diabete, presentano maggiori:
- complicanze oculari (retinopatia);
- complicanze renali (insufficienza renale cronica);
- complicanze cardiovascolari (infarto, ictus);
- rischio di morte.
In pratica la parodontite è strettamente legata a uno scarso controllo della glicemia (HbA1C) (18,19,20) e ad alti livelli di zuccheri nel sangue sia in pazienti diabetici sia in quelli non diabetici. Pertanto chi ha la parodontite ha più alti livelli di resistenza all’insulina. Se la diagnosi di parodontite è posta precocemente e comunque prima della distruzione di gran parte del legamento alveolo-dentale, è trattabile in modo efficace nella maggior parte dei pazienti. La terapia parodontale causale si è rivelata efficace nel migliorare il controllo glicemico in termini di HbA1c. Il valore meta-analitico della riduzione di HbA1c a tre mesi dal termine della terapia parodontale si attesta allo 0.40%.
Purtroppo la percentuale di casi di parodontite e diabete non diagnosticati è molto elevata. È quindi indispensabile aumentare la conoscenza sulla corretta diagnosi e sulla consapevolezza dei pazienti sulle strette relazioni fra salute parodontale e diabete, oltre che sulla necessità di azioni specifiche per affrontare i fattori di rischio (fumo, malnutrizione, sedentarietà, obesità) legati a entrambe le patologie.
 Malattia parodontale e malattie cardiovascolari
Malattia parodontale e malattie cardiovascolari
Le malattie cardiovascolari rappresentano ancora la principale causa di morte nel nostro Paese, essendo responsabili del 34,8% di tutti i decessi. L’associazione tra malattia parodontale e malattie cardiovascolari (7, 21) si può spiegare attraverso i due meccanismi (22) seguenti.
- Meccanismo diretto: in seguito a semplici manovre che espongano i siti parodontali al sanguinamento, può verificarsi una migrazione di batteri dai tessuti parodontali al sangue circolante (batteriemia) con conseguenti danni alle pareti dei vasi sanguigni (endotelio);
- Meccanismo indiretto: fa riferimento alla produzione locale di sostanze chimiche tipiche dell’infiammazione da parte del parodonto, in grado di raggiungere il sistema circolatorio favorendo la deposizione a distanza di colesterolo lungo le pareti vascolari arteriose (placche ateromasiche), con conseguente aumento del rischio trombotico.
Le possibili ragioni di queste associazioni (22-25) includono i seguenti fattori.
- Una maggiore incidenza di batteriemia che entra nel flusso sanguigno in pazienti con gengiviti o parodontiti, causando potenzialmente vari effetti sistemici.
- Nei pazienti con parodontite sono presenti batteri più virulenti, con conseguente maggiore infiammazione, che può innescare eventi con effetti negativi sulla salute generale.
- I patogeni della parodontite (per esempio Porphyromonas gingivalis) promuovono la formazione di ateroma e accelerano l’aterosclerosi.
- I patogeni parodontali generano anticorpi (anticorpi anticardiolipina) che potrebbero eventualmente reagire in modo crociato con il sistema cardiovascolare del paziente, contribuendo eventualmente all’insorgenza di malattia cardiovascolare
Rispetto ai soggetti sani, i pazienti con parodontite presentano:
- un livello più elevato di citochine e mediatori dell’infiammazione, che sono stati associati a una maggiore incidenza di malattia cardiovascolare;
- un livello più alto di fibrinogeno (fattori trombotici);
- livelli più elevati colesterolo, LDL, trigliceridi, VLDL, LDL ossidato eccetera.
Poiché è emerso che il trattamento parodontale possa ridurre il rischio di aterosclerosi, è quindi molto importante mantenere una buona igiene orale con una routine quotidiana igiene orale almeno due volte al giorno con pulizia interdentale, e un programma di visite regolari per curare eventuali malattie gengivali. I pazienti con parodontite devono essere informati che hanno un rischio maggiore di soffrire di malattie cardiovascolari e che pertanto dovrebbero gestire i loro fattori di rischio, in particolare fumo, stress, obesità e cattiva alimentazione, che aumentano il rischio di entrambe le malattie.
Parodontite e artrite reumatoide
L’artrite reumatoide (26, 27) è considerata una malattia autoimmune la cui esatta causa non è nota. È un’artrite infiammatoria in cui le articolazioni, in genere quelle delle mani e dei piedi, sviluppano un’infiammazione, dando luogo a gonfiore, dolore e spesso distruzione dell’articolazione stessa. L’artrite reumatoide si sviluppa nell’1% circa della popolazione mondiale, indipendentemente dall’etnia, con una incidenza 2-3 volte superiore nelle donne rispetto agli uomini; solitamente compare per la prima volta tra i 35 e i 50 anni, ma può insorgere a ogni età. Per quanto riguarda la relazione con la malattia parodontite (28,29,30), vi è una prevalenza molto maggiore di artrite reumatoide in pazienti con parodontite (4%) rispetto alla popolazione generale (1%); viceversa si stima che la prevalenza di parodontite in pazienti con artrite reumatoide sia 4 volte superiore rispetto ai soggetti non artritici. Tra le caratteristiche principali dell’artrite reumatoide (26,31) vi è la produzione degli anticorpi ACPA (anti–citrullinated protein antibody – anticorpi anti peptidi ciclici citrullinati) volti all’eliminazione della citrulla, un amminoacido che il corpo riconosce come un agente estraneo. L’autoimmunità dell’artrite reumatoide sarebbe caratterizzata dalla risposta degli anticorpi alla sovrapproduzione di citrullinate e il batterio orale Porphyromonas gingivalis sarebbe l’unico agente patogeno noto capace di rilasciare l’enzima PPAD, peptidilargina deiminasi, in grado di stimolare la produzione di anticorpi anticitrullina. Questo enzima sembra comportare anche modificazioni di proteine dell’organismo e stimolare la formazione di anticorpi coinvolti nella risposta autoimmunitaria. Di conseguenza l’infiammazione parodontale e i batteri che ne sono responsabili potrebbero giocare un ruolo fondamentale nello sviluppo dell’autoimmunità correlata all’artrite reumatoide e magari anche rappresentare la causa e non l’effetto della malattia. I batteri parodontopatogeni sarebbero in grado di stimolare la produzione di anticorpi ACPA e, allo stesso tempo, di esacerbare la risposta infiammatoria del sistema immunitario, producendo un aumento della distruzione ossea sia a livello articolare che a livello dei tessuti di supporto del dente. E in effetti i soggetti con artrite reumatoide hanno una perdita di attacco parodontale significativamente maggiore rispetto ai controlli.
Oltre alla correlazione microbiologica, parodontite e artrite reumatoide condividono altri fattori di rischio come fumo e predisposizione genetica. Inoltre, alcuni farmaci usati per la terapia dell’artrite possono interferire a livello gengivale e aggravare lo stato dell’infiammazione parodontale. Per quanto riguarda la gestione di tali pazienti, si ricorda che si verificano con maggiore frequenza casi più gravi di parodontite nei pazienti con artrite reumatoide e viceversa. L’artrite reumatoide può essere preannunciata dalla perdita di massa ossea nella mascella. Inoltre, i pazienti più suscettibili all’artrite reumatoide hanno un rischio maggiore di sviluppare infezioni a causa di alterazioni del sistema immunitario e di altri fattori esterni. In questi pazienti un controllo attento dell’artrite reumatoide può aumentare il successo del trattamento della parodontite, mitigando la risposta infiammatoria. La continua ricerca per chiarire scientificamente il legame tra parodontite e artrite è fondamentale sia dal punto di vista preventivo che terapeutico dato che l’igiene orale può incidere solo in parte su questa associazione (32).
Malattie gengivali e terapie farmacologiche
Come conseguenza della vasta diffusione delle patologie croniche che affliggono la popolazione, risulta sempre più elevata la probabilità che i nostri pazienti facciano uso di farmaci in grado di influenzare o provocare, in generale e in funzione della risposta individuale, una serie di effetti tra cui l’infiammazione parodontale, l’eccessiva crescita del volume e l’aumento del sanguinamento gengivale (33,34,35). È quindi importante conoscere le terapie farmacologiche assunte dal singolo paziente al fine di poter individuare la necessità di attuare trattamenti parodontali personalizzati. L’eccessiva crescita gengivale è un noto effetto di alcune categorie di farmaci il cui organo bersaglio non è il tessuto gengivale, in particolare gli anticonvulsivanti (fenitoina), gli agenti immunosoppressivi (ciclosporina) e gli antipertensivi (calcio-antagonisti).
I fattori considerati coinvolti nell’ipertrofia gengivale farmacoindotta, DIGO (drug-induced gingival overgrowth), sono:
- l’età, poiché nei pazienti trattati con fenitoina la combinazione tra giovane età e scarsa igiene orale sembra predisporre a una maggiore severità della manifestazione;
- il genere, poiché i maschi sono più predisposto a svilupparla;
- le variabili farmacologiche.
La DIGO si verifica nel 6.3%-83% di pazienti sottoposti a terapia con inibitori dei canali del calcio (CCB) per patologia cardiovascolare ed è caratterizzata da un accumulo di matrice extracellulare nel tessuto gengivale che solitamente inizia nel primo mese di somministrazione del farmaco. La quantità di placca sulla superficie dei denti e l’infiammazione gengivale hanno un effetto negativo sulla comparsa della DIGO a prescindere dal tipo di farmaco assunto, sebbene il controllo della placca non elimini completamente la comparsa dei segni clinici della DIGO. L’ingrossamento gengivale può essere ridotto al minimo, ma non prevenuto, mediante l’eliminazione degli irritanti locali, una meticolosa igiene orale e un regolare richiamo parodontale; può però ripresentarsi, specialmente nei pazienti con scarsa igiene orale. La gestione medica è la prima linea di trattamento, poiché si può valutare la possibilità di sospendere o sostituire il farmaco che causa la DIGO: ovviamente deve essere l’odontoiatra congiuntamente con il medico curante a valutare costi e benefici della sospensione o sostituzione; in ogni caso, se la terapia medica è modificabile, bisogna attendere tra i 6 e i 12 mesi per valutare la risoluzione della condizione gengivale.
Trattamenti radianti e chemioterapici
Anche i trattamenti di radioterapia e chemioterapia (36) influiscono sullo stato di salute del cavo orale: la mucosite, la disfunzione delle ghiandole salivari, l’alterazione del gusto e il dolore sono le complicanze più frequenti. Un’altra possibile conseguenza, grave e rara (4% di incidenza), delle radioterapie nella regione testa-collo e dei farmaci antiriassorbitivi associati alle terapie oncologiche è l’osteoradionecrosi delle ossa mascellari. Il trattamento radio-chemioterapico (36,37,38) può determinare l’insorgenza di mucosite e/o la sensazione di bocca secca, che si può presentare in due modi differenti: effettiva secchezza orale (xerostomia) o riduzione netta della salivazione (iposcialia o iposalivazione), che a sua volta può portare a viscosità eccessiva della saliva, saliva schiumosa, alterazione del gusto di varia entità, difficoltà a deglutire (disfagia), nausea, carie, infezioni e parodontite. In tali situazioni l’adozione di protocolli di mantenimento personalizzati può prevedere anche l’uso di sostituti salivari o presidi atti a dare sollievo al paziente.
Conclusione
Da quanto fin qui esposto risulta quantomai importante l’attività di prevenzione svolta dall’igienista dentale, che acquisisce un respiro ben più ampio se si pensa a tutte le patologie sistemiche che possono essere determinate o aggravate dalla presenta di malattia parodontale, che a sua volta, come abbiamo visto, può essere provocata o peggiorata da diverse condizioni sistemiche. Risulta pertanto fortemente auspicabile una stretta collaborazione dell’igienista dentale con le altre figure sanitare coinvolte nella prevenzione e nella gestione dei soggetti a rischio, al fine di diagnosticare e trattare i pazienti il più precocemente possibile e mantenere sempre alto il livello di salute orale e sistemica.
1.
Petersmann A, Müller-Wieland D, Müller UA, Landgraf R, Nauck M, Freckmann G, Heinemann L, Schleicher E. Definition, Classification and Diagnosis of Diabetes Mellitus. Experimental and Clinical Endocrinology & Diabetes 2019;127(S 01):S1—S7.
2.
Ministero della salute. Diabete Mellito tipo 1. Ministero della salute, consultato il 29/10/2021. https://www.salute.gov.it/portale/nutrizione
3.
Ministero della salute. Linee guida nazionali per l’attività fisica: raccomandazioni per le persone con diabete mellito tipo 2. Ministero della salute, consultato il 20/10/2021. https://www.salute.gov.it/portale
4.
Ministero della salute. Diabete mellito tipo 2. Ministero della salute, consultato il 20/10/2021. https://www.salute.gov.it/portale/nutrizione
5.
Ministero della salute. Sintomi e segni diabete mellito tipo 2. Ministero della salute, consultato il 22/10 /2021. https://www.salute.gov.it/portale
6.
Jepsen S, Caton JG, Albandar JM, Bissada NF, Bouchard P, Cortellini P, Demirel K, de Sanctis M, Ercoli C, Fan J, Geurs NC, Hughes FJ, Jin L, Kantarci A, Lalla E, Madianos PN, Matthews D, McGuire MK, Mills MP, Yamazaki K. Periodontal manifestations of systemic diseases and developmental and acquired conditions: Consensus report of workgroup 3 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. J Periodontol 2018;89:S237—S248.
7.
Albandar JM, Susin C, Hughes FJ. Manifestations of systemic diseases and conditions that affect the periodontal attachment apparatus: Case definitions and diagnostic considerations. J Periodontol 2018;89: S183—S203.
8.
Chapple IL, Van der Weijden F, Doerfer C, Herrera D, Shapira L, Polak D, Madianos,P, Louropoulou A, Machtei E, Donos N et al. Primary prevention of periodontitis: Managing gingivitis. J Clin Periodontol 2015; 42:S71–S76.
9.
Lang NP, Bartold PM. Periodontal health. J Periodontol 2018;89:S9—S16.
10.
Lalla E, Papapanou PN. Diabetes mellitus and periodontitis: a tale of two common interrelated diseases. Nature Reviews Endocrinology 2011;7(12):738–748.
11.
King GL. The role of inflammatory cytokines in diabetes and its complications. J Periodontol 2008;79:1527-34
12.
Chapple ILC, Mealey BL, Van Dyke TE, Bartold PM, Dommisch H, Eickholz P, Geisinger ML, Genco RJ, Glogauer M, Goldstein M, Griffin TJ, Holmstrup P, Johnson GK, Kapila Y, Lang NP, Meyle J, Murakami S, Plemons J, Romito GA, Yoshie H. Periodontal health and gingival diseases and conditions on an intact and a reduced periodontium: Consensus report of workgroup 1 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. J Periodontol 2018;89:S74—S84.
13.
Poskerová H, Linhartová P, Vokurka J, Fassmann A, Hollá L. Diabetes Mellitus and Oral Health. Česká stomatologie/Praktické zubní lékařství 2014;114(5), 75–86.
14.
Caton JG, Armitage G, Berglundh T, Chapple ILC, Jepsen S, Kornman KS, Mealey BL, Papapanou PN, Sanz M, Tonetti, MS. A new classification scheme for periodontal and peri-implant diseases and conditions - Introduction and key changes from the 1999 classification. J Periodontol2018;89:S1—S8.
15.
American Diabetes Association https://diabetes.org/diabetes/a1c#:~:text=The%20goal%20for%20most%20adults,that%20is%20less%20than%207%25.&text=If%20your%20A1C%20level%20is,were%20in%20the%20diabetes%20range.
16.
Allen EM, Matthews JB, O’ Halloran DJ, Griffiths HR, Chapple IL. Oxidative and inflammatory status in Type 2 diabetes patients with periodontitis. J Clin Periodontol 2011;38(10):894–901.
17.
Löe H. Periodontal disease. The sixth complication of diabetes mellitus. Diabetes Care 1993 Jan;16(1):329-34.
18.
Sanz, M., Ceriello, A., Buysschaert, M., Chapple, I., Demmer, R. T., Graziani, F., Herrera, D., Jepsen, S., Lione, L., Madianos, P., Mathur, M., Montanya, E., Shapira, L., Tonetti, M., & Vegh, D. (2017). Scientific evidence on the links between periodontal diseases and diabetes: Consensus report and guidelines of the joint workshop on periodontal diseases and diabetes by the International Diabetes Federation and the European Federation of Periodontology. Journal of Clinical Periodontology, 45(2), 138–149.
19.
Baeza, M., Morales, A., Cisterna, C., Cavalla, F., Jara, G., Isamitt, Y., Pino, P., & Gamonal, J. (2020). Effect of periodontal treatment in patients with periodontitis and diabetes: systematic review and meta-analysis. Journal of Applied Oral Science, 28.
20.
Cao, R., Li, Q., Wu, Q., Yao, M., Chen, Y., & Zhou, H. (2019). Effect of non-surgical periodontal therapy on glycemic control of type 2 diabetes mellitus: a systematic review and Bayesian network meta-analysis. BMC Oral Health, 19(1).
21.
Fiorillo L. Oral health: the first step to well-being. Medicina 2019;55(10):676.
22.
Sanz, M., Del Castillo, A. M., Jepsen, S., Gonzalez-Juanatey, J. R., D’Aiuto, F., Bouchard, P., Chapple, I., Dietrich, T., Gotsman, I., Graziani, F., Herrera, D., Loos, B., Madianos, P., Michel, J. B., Perel, P., Pieske, B., Shapira, L., Schechter, M., Tonetti, M., … Wimmer, G. (2020). Periodontitis and Cardiovascular Diseases. Consensus Report. Global Heart, 15(1), 1.
23.
Bozoglan, A., Ertugrul, A. S., Taspınar, M., & Yuzbasioglu, B. (2017). Determining the relationship between atherosclerosis and periodontopathogenic microorganisms in chronic periodontitis patients. Acta Odontologica Scandinavica, 75(4), 233–242.
24.
Persson, G. R., & Persson, R. E. (2008). Cardiovascular disease and periodontitis: an update on the associations and risk. Journal of Clinical Periodontology, 35, 362–379.
25.
Almeida, A. P. C. P. S. C., Fagundes, N. C. F., Maia, L. C., & Lima, R. R. (2018). Is there an Association Between Periodontitis and Atherosclerosis in Adults? A Systematic Review. Current Vascular Pharmacology, 16(6), 569–582.
26.
Smolen, J. S., Aletaha, D., & McInnes, I. B. (2016). Rheumatoid arthritis. The Lancet, 388(10055), 2023–2038.
27.
Farid, S. S., Azizi, G., & Mirshafiey, A. (2013). Anti-citrullinated protein antibodies and their clinical utility in rheumatoid arthritis. International Journal of Rheumatic Diseases, 16(4), 379–386.
28.
Liao, F., Li, Z., Wang, Y., Shi, B., Gong, Z., & Cheng, X. (2009). Porphyromonas gingivalis may play an important role in the pathogenesis of periodontitis-associated rheumatoid arthritis. Medical Hypotheses, 72(6), 732–735.
29.
de Smit MJ, Westra J, Brouwer E, Janssen KM, Vissink A, van Winkelhoff AJ. Periodontitis and Rheumatoid Arthritis: What Do We Know? J Periodontol. 2015 Sep;86(9):1013-9.
30.
Konig MF, Paracha AS, Moni M, Bingham CO 3rd, Andrade F. Defining the role of Porphyromonas gingivalis peptidylarginine deiminase (PPAD) in rheumatoid arthritis through the study of PPAD biology. Ann Rheum Dis. 2015 Nov;74(11):2054-61.
31.
Sato, K., & Yamazaki, K. A novel mechanism linking periodontitis and rheumatoid arthritis. Nihon Shishubyo Gakkai Kaishi (Journal of the Japanese Society of Periodontology) 2019;61(3):142-147.
32.
Pischon, N., Pischon, T., Kröger, J., Gülmez, E., Kleber, B. M., Bernimoulin, J. P., Landau, H., Brinkmann, P. G., Schlattmann, P., Zernicke, J., Buttgereit, F., & Detert, J. (2008). Association Among Rheumatoid Arthritis, Oral Hygiene, and Periodontitis. Journal of Periodontology, 79(6), 979–986.
33.
Seymour, R. A., Ellis, J. S., & Thomason, J. M. (2000). Risk factors for drug-induced gingival overgrowth. Journal of Clinical Periodontology, 27(4), 217–223.
34.
Boratynska, M., Radwan-Oczko, M., Falkiewicz, K., Klinger, M., & Szyber, P. (2003). Gingival overgrowth in kidney transplant recipients treated with cyclosporine and its relationship with chronic graft nephropathy. Transplantation Proceedings, 35(6), 2238–2240.
35.
James, J. A., Marley, J. J., Jamal, S., Campbell, B. A., Short, C. D., Johnson, R. W. G., Hull, P. S., Spratt, H., Irwin, C. R., Boomer, S., Maxwell, A. P., & Linden, G. J. (2000). The calcium channel blocker used with cyclosporin has an effect on gingival overgrowth. Journal of Clinical Periodontology, 27(2), 109–115.
36.
Grau, C., Andreassen, C. N., Jensen, K., & Lindegaard, J. C. (2004). Oral Complications of Radiotherapy in Head and Neck Cancer. American Journal of Cancer, 3(5), 291–298.
37.
Ray-Chaudhuri, A., Shah, K., & Porter, R. J. (2013). Radiotherapy: Oral management of patients who have received radiotherapy to the head and neck region. Vital, 10(2), 30–36.
38.
Andrews, N., & Griffiths, C. (2001). Dental Complications of Head and Neck Radiotherapy: Part 2. Australian Dental Journal, 46(3), 174–182.
39.
Hancock PJ, Epstein JB, Sadler GR. Oral and dental management related to radiation therapy for head and neck cancer. J Can Dent Assoc. 2003 Oct;69(9):585-90.









